Образование солей аммония при действии водных растворов минеральных кислот свидетельствует о том, что амины – более сильные основания, чем Н2О.
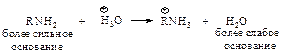
Амины вытесняются из солей аммония при действии гидроксид-иона, т.е. амины более слабые основания, чем гидроксид-ион.
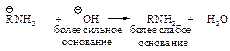
Основность убывает в ряду ОНy>RNH2>H2O.
По аналогии с кислотностью основность аминов удобно сравнивать, определяя степень переноса протона с воды на амин.
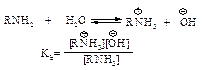
Чем больше константа основности Кb, тем сильнее основание. Константа основности Kb для всех трех классов алифатических аминов 10–3–10–4, т.е. алифатические амины более сильные основания, чем аммиак Kb=1,8∙10-5. Для ароматических аминов Kb<10–9.
Структура и основность. Наличие заместителей оказывает сильное влияние на основность. Алифатические амины – более сильные основания, чем аммиак.
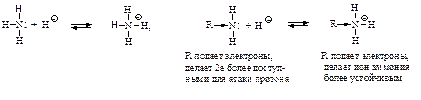
Основность алифатических аминов увеличивается в ряду NH3<R1NH2<R1–NH–R2. Ароматические амины более слабые основания, чем аммиак. Пара электронов азота обобществлена с электронами кольца и поэтому менее доступна для образования связи с ионом водорода.
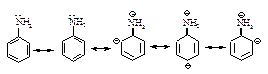
 2015-06-24
2015-06-24 470
470








