Активність ферментів визначається їхньою тривимірною структурою[4].
Як і всі білки, ферменти синтезуються у вигляді лінійного ланцюжка амінокислот, який згортається певним чином. Кожна послідовність амінокислот згортається особливим чином, і молекула (білкова глобула), що виходить, володіє унікальними властивостями. Кілька білкових ланцюжків можуть об'єднуватися у білковий комплекс. Найбільші рівні структури білків — третинна та четвертинна структури — руйнуються при нагріванні або під дією деяких хімічних речовин.
Щоб каталізувати реакцію, фермент повинен зв'язатися з одним або кількома субстратами. Білковий ланцюжок ферменту згортається таким чином, що на поверхні глобули утворюється щілина або западина, до якої приєднуються молукули субстрату. Ця область називається ділянкою (сайтом) зв'язування субстрата. Зазвичай вона співпадає з активним центром ферменту або знаходиться поблизу від нього. Деякі ферменти містять також ділянки зв'язування кофакторів або іонів металів.
У деяких ферментів присутні також ділянки зв'язування малих молекул, що не беруть безпосередньої участі в реакції і часто, але не обов'язково, є субстратами або продуктами метаболічного шляху, в який входить фермент. Вони зменшують або збільшують активність ферменту, що створює можливість для зворотного зв'язку або регуляції роботи ферменту.
Выводы:
Ферменты характеризуются следующими основными свойствами.
1. Все они представляют собой глобулярные белки.
2. Информация о них, как и о других белках, закодирована в ДНК.
3. Ферменты действуют как катализаторы.
4. Их присутствие не влияет ни на природу, ни на свойства конечного продукта реакции.
5. Ферменты действуют чрезвычайно эффективно, т. е. очень малое количество фермента вызывает превращение больших количеств субстрата. Одна молекула каталазы способна, например, при температуре тела разложить за одну секунду на воду и кислород около 600 тысяч молекул пероксида водорода.
6. Ферменты высокоспецифичны, т. е. один фермент катализирует обычно только одну реакцию. Каталаза, например, катализирует только расщепление пероксида водорода.
7. Катализируемая ферментом реакция обратима.
8. Активность ферментов меняется в зависимости от рН и температуры, а также от концентрации как субстрата, так и самого фермента.
9. Ферменты снижают энергию активации катализируемой реакции.
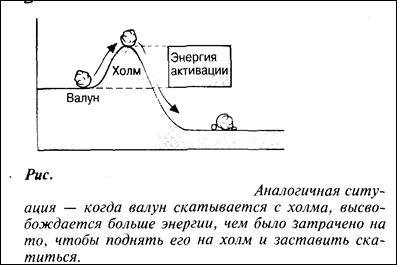 10. В молекуле фермента есть активный центр, который вступает в контакт с субстратом. Этот активный центр имеет особую форму.
10. В молекуле фермента есть активный центр, который вступает в контакт с субстратом. Этот активный центр имеет особую форму.
 2015-06-26
2015-06-26 1161
1161








