На активность сложных молекул фермента влияют различные вещества, не обязательно все, присутствующие в окружающей среде. Молекулы этих веществ могут образовывать связи с различными участками молекулы фермента. При этом возникают два основных варианта ингибирования.
Конкурентное (изостерическое) ингибировагие – молекула ингибитора I образует связь с активным центром фермента, мешая связыванию субстрата S. Концентрация фермент-субстратного комплекса понижается, и скорость ферментативной реакции уменьшается.
|
|
 E …. I
E …. I
|
|
 E
E E … S
Однако при большой концентрации субстрат полностью вытесняет молекулы ингибитора, в результате чего достигается та же самая максимальная скорость. В координатах Лайнуивера-Бёрка график зависимости скорости от концентрации субстрата проходит через ту же точку на оси ординат (1/ v max), но с большим углом наклона (см. рис. 7). Следовательно, при конкурентном ингибировании изменяется константа Михаэлиса. Роль конкурентного ингибитора может выполнять продукт реакции. Если при участии фермента значительно повышается концентрация продукта, то он, занимая активный центр, препятствует образованию комплекса E … S, и приостанавливает дальнейшее образование собственных молекул.
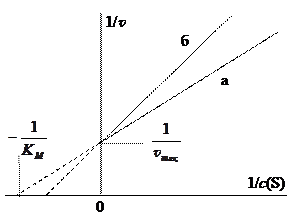
Рис. 7. Зависимости в координатах Лайнуивера-Бёрка
для реакции без ингибитора (а) и с ингибитором (б)
Возможно также взаимодействие разных молекул не с активным центром фермента, а с другими участками его молекулы. Эти молекулы не имеют структурного сходства с субстратом. При таком воздействии на фермент также может понижаться его активность. Этот вид ингибирования называется неконкурентным или аллостерическим. Независимо от концентраций, такой ингибитор не может быть вытеснен субстратом. Он может связываться как со свободной молекулой фермента, так и с фермент-субстратным комплексом. Такие воздействия на фермент следует иметь в виду при эпизодах заболеваний, в которых проявляется понижение активности фермента. Не исключается и ингибирующее действие субстрата на активность данного фермента. Легко себе представить, что субстрат связывается не только с активным центром фермента, но и с каким-то еще участком этой молекулы, становясь ингибитором.
Фермент, имеющий аллостерический центр, участвующий в изменении его активности, называют регуляторным или аллостерическим. Такие ферменты автоматически управляют биохимическими процессами клетки.
Так в чем же сущность такого ингибирования? Связывание молекулы ингибитора вызывает изменение конформации фермента. В определенной степени меняется взаимное расположение функциональных групп в активном центре. Это не препятствует образованию E … S-комплекса, но препятствует превращению субстрата в продукт реакции. Неконкурентное ингибирование может быть как обратимым, зависящим от концентрации ингибитора, так и необратимым в случае образования прочной связи E … I. Ядами для ферментов могут быть ионы тяжелых металлов (Cd2+, Ag+, Hg2+, Tl+ и др), окислители, сильные донорные молекулы и т. д.
Для обратимого неконкурентного ингибирования характерно уменьшение максимальной скорости реакции при постоянстве константы Михаэлиса. На графике Лайнуивера-Бёрка это выглядит следующим образом:
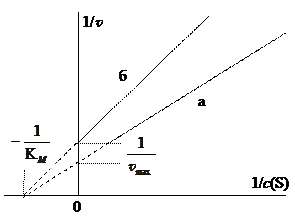
Рис. 8. а – реакция без ингибирования,
б – реакция с неконкурентным ингибированием.
Известно, что для некоторых белков существуют активаторы ферментативной активности, называемые коферментами. Ферментом оказывается не белок как таковой, а его комплекс с коферментом.
Ферментативные процессы с участием ингибиторов подчиняются более сложным кинетическим уравнениям, чем уравнение Михаэлиса-Ментен.
Ферментативные процессы, описываемые уравнением Михаэлиса-Ментен достаточно типичны, но существуют и более сложные процессы, знакомство с которыми у вас состоится при дальнейшем изучении медицинских наук.
 2015-06-26
2015-06-26 1197
1197
