Рассмотрим систему с эвтектическим превращением, в которой компоненты А (1) и В (2) неограниченно растворимы в жидкой фазе и образуют идеальный раствор, а твердые вещества А и В взаимно нерастворимы. Диаграмма состояния такой системы имеет линию эвтектического приращения ДЕF и две ветви ликвидуса СЕ и НЕ, сходящиеся в точке «Е». Ветви ликвидуса – это линии насыщения расплава кристаллами одного из веществ (растворителя). Для растворов, у которых мольная доля второго компонента N2<E, растворителем является вещество А, а для растворов с N2>E, растворитель – вещество В.
При температуре начала кристаллизации Тн.к.=Тх расплав с N1=1-x находится в равновесии с кристаллами А. Условие равновесия - равенство давлений насыщенного пара растворителя над жидкой и твердой фазами.
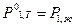 , (1)
, (1)
где 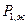 - давление насыщенного пара растворителя над жидким раствором при Тн.к.;
- давление насыщенного пара растворителя над жидким раствором при Тн.к.;
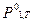 - то же над кристаллами чистого растворителя.
- то же над кристаллами чистого растворителя.
В рассматриваемом случае раствор идеален, т.е. подчиняется закону Рауля.
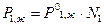 , (2)
, (2)
где 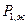 - давление насыщенного пара растворителя над чистым жидким растворителем при той же температуре;
- давление насыщенного пара растворителя над чистым жидким растворителем при той же температуре;
N 1 - мольная доля растворителя в растворе.
С учетом равенства (2) уравнение (1) примет вид
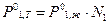 . (3)
. (3)
После логарифмирования и последующего дифференцирования по температуре получим
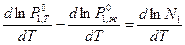 . (4)
. (4)
Зависимость между давлением насыщенного пара и
температурой над чистым компонентом в жидкой или твердой фазе описывается уравнением Клазиуса-Клапейрона
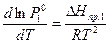 , (5)
, (5)
где 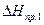 - мольная теплота фазового перехода (испарения или сублимации) растворителя.
- мольная теплота фазового перехода (испарения или сублимации) растворителя.
С учетом выражения (5) и соотношения
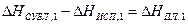 , (6)
, (6)
уравнение (3) приводится к виду
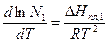 . (7)
. (7)
Дифференциальное уравнение (7) связывает температуру и состав идеального раствора, насыщенного кристаллами растворителя. Чтобы получить его интегральную форму, надо знать вид функции 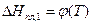 . Приняв в первом приближении теплоту плавления растворителя постоянной, после разделения переменных и интегрирования выражения (7) от 1 состояния (растворитель) до 2-го (раствор), получим:
. Приняв в первом приближении теплоту плавления растворителя постоянной, после разделения переменных и интегрирования выражения (7) от 1 состояния (растворитель) до 2-го (раствор), получим:
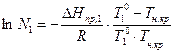 , (8)
, (8)
где 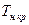 - температура начала кристаллизации растворителя из раствора;
- температура начала кристаллизации растворителя из раствора;
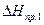 - мольная теплота плавления растворителя;
- мольная теплота плавления растворителя;
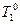 - температура кристаллизации растворителя;
- температура кристаллизации растворителя;
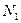 - мольная доля растворителя в растворе.
- мольная доля растворителя в растворе.
Таким образом, для рассматриваемого случая расчета ветвей ликвидуса необходимо знать справочные значения температур и теплот плавления компонентов. Для некоторых металлов они приведены в приложении 2. При выполнении расчетов данные следует свести в табл.1.
Таблица 1
Составы расплавов, насыщенных кристаллами
Растворителя в системе … - …
| Растворитель | Температура начала кристаллизации | 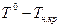
| Концентрация растворителя | ||
| °С | К | LnN | N | ||
| …………. …………. |
Если от выражения (7) взять неопределенный интеграл, то получим:
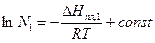 ; (9)
; (9)
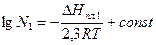 ; (10)
; (10)
или
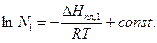 (10`)
(10`)
Этим уравнением удовлетворяет прямая линия в координатах 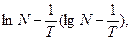 угловой коэффициент которой пропорционален теплоте плавления растворителя.
угловой коэффициент которой пропорционален теплоте плавления растворителя.
Итак, по известной диаграмме состояния системы, можно определить теплоты плавления компонентов.
Пример. Определить графически теплоту плавления германия и сравнить ее со справочным значением. Для расчета воспользоваться диаграммой состояния системы цинк-германий [6, 7].
На диаграмме фазового состояния системы Zn-Ge (рис.9) ветвь ликвидуса AE – это линия насыщения расплава кристаллами Ge
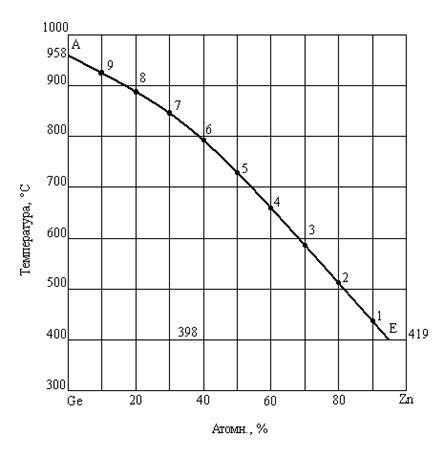
Рис. 1. Диаграмма состояния системы германий-цинк
Для графического определения теплоты плавления германия возьмем на линии АЕ несколько точек и найдем для них значения 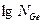 и 1/Т (табл.2).
и 1/Т (табл.2).
По данным табл. 2 построен график в координатах 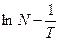 (рис. 2). На нем выбранные точки располагаются вблизи прямой линии. Ее угловой коэффициент найдем по координатам точек «а» и «б».
(рис. 2). На нем выбранные точки располагаются вблизи прямой линии. Ее угловой коэффициент найдем по координатам точек «а» и «б».
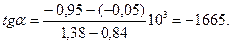
Таблица 2
Составы расплавов германий-цинк, насыщенных германием,
при различных температурах
| Содержание в расплаве | Температура | 103/Т К-1 | |||
| ат. % | N | lgN | °С | К | |
| 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 | -1,000 -0,700 -0,522 -0,400 -0,299 -0,222 -0,156 -0,096 -0,047 | 1,383 1,253 1,145 1,055 0,997 0,941 0,890 0,860 0,831 |
Из выражения (10) следует, что угловой коэффициент прямой с теплотой плавления растворителя связан равенством
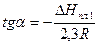 (19)
(19)
или
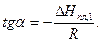 (19`)
(19`)
Откуда 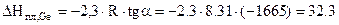 кДж/моль.
кДж/моль.
В прил. 2 находим справочное значение  =37,00 и 34,3кДж/моль, что удовлетворительно совпадает с полученным результатом.
=37,00 и 34,3кДж/моль, что удовлетворительно совпадает с полученным результатом.
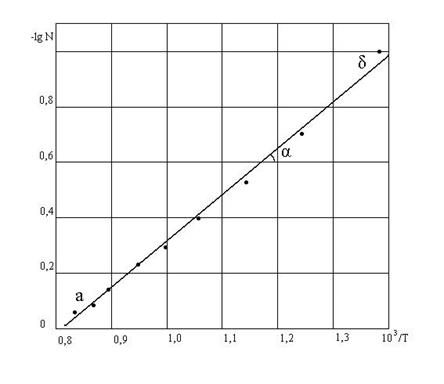
Рис. 2. К графическому методу определения теплоты плавления вещества.
ПРИЛОЖЕНИЕ 4
 2015-07-04
2015-07-04 421
421








