Диаграммы состояния однокомпонентных систем отражают свойства одного вещества, простого или сложного, химический состав которого постоянен, и на свойства которого влияют лишь внешние независимые переменные (температура и давление).
Диаграммы состояния таких систем могут быть изображены на плоскости в координатах Р - Т или P - V, где V - объем. Максимальное число фаз, находящихся в равновесии в однокомпонентных системах, в соответствии с правилом фаз Гиббса равно трем:
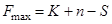 при n = 1 и S = 0
при n = 1 и S = 0 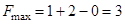 .
.
Эти фазы могут сосуществовать лишь при строго фиксированных параметрах, поскольку система при этом не имеет степеней свободы.
На рис. 1 в качестве примера изображена простейшая объемная диаграмма состояния углекислого газа, а также ее проекции в координатах P - V, T - V и Р - Т.
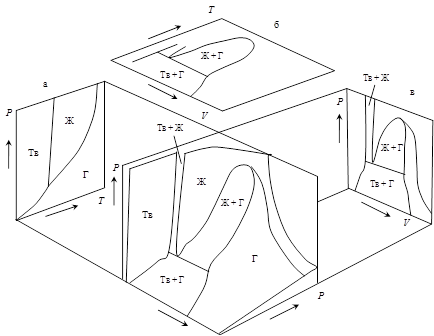
Рис. 1. Объемная диаграмма состояния углекислого газа и ее проекции на плоскости P - T (a), T – V (б) и P – V (в).
На практике чаще всего применяется диаграмма состояния, построенная в координатах давление - температура, показанная на рис. 2.

Рис. 2. Плоская диаграмма состояния углекислого газа, построенная в координатах P – T, где 1, 2, 3, 4 – условные точки.
Линии ОА, ОK и ОВ разделяют диаграмму на три поля, показывающие области существования, т.е. пределы температур и давлений, трех устойчивых агрегатных состояний вещества: твердого, жидкого и газообразного. В каждом из этих состояний система имеет две степени свободы.
На линиях диаграммы в равновесии находятся две фазы: на линии испарения (конденсации) ОK – газ и жидкость, на линии плавления (кристаллизации) ОА – жидкая и твердая фазы, а на линии возгонки (сублимации) ОВ – твердая фаза и пары. Каждая линия диаграммы показывает взаимосвязь температуры соответствующего фазового превращения и внешнего давления или давления насыщенного пара.
Линия OD показывает область существования метастабильной фазы. В данном случае – переохлажденной жидкости, т.к. линию OD можно представить как продолжение линии ОА. Подобные штриховые линии часто можно видеть также на диаграммах состояния компонентов, представленных различными кристаллическими модификациями. Переход одной модификации в другую обычно происходит очень медленно и сопровождается поэтому длительным сохранением метастабильных при данных параметрах твердых фаз, переходящих в устойчивые фазы лишь после длительной выдержки.
Наклон граничных линий определяется соотношением плотностей фаз, находящихся в равновесии.
Ход линий диаграммы описывается уравнением Клапейрона-Клаузиуса, которое в дифференциальной форме имеет вид:
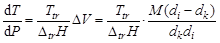 ,
,
где Δ trH – изменение энтальпии (теплота) фазового перехода, Дж/моль; Ttr – температура фазового перехода, K; Δ V – изменение молярного объема в процессе фазового перехода, м3/моль, М – молярная масса вещества, кг/моль; dk и di – плотности вещества в исходном и конечном фазовом состояниях, кг/м3.
При испарении, плавлении или возгонке веществ и других процессах, протекающих с поглощением тепла, т.е. при Δ trH > 0, знак производной d T /d P, определяющий наклон кривых на диаграмме, зависит только от знака разности плотностей исходной и конечной фаз.
Если 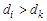 , то d T /d P > 0 (рис. 3, а), и с ростом давления температура фазового превращения увеличивается.
, то d T /d P > 0 (рис. 3, а), и с ростом давления температура фазового превращения увеличивается.
Если 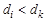 , то d T /d P < 0 (рис. 3, б), и с ростом давления температура фазового превращения уменьшается.
, то d T /d P < 0 (рис. 3, б), и с ростом давления температура фазового превращения уменьшается.
а) 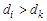 ; б)
; б) 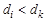 .
.
Точка О, в которой пересекаются три линии фазовых переходов, называется тройной точкой, показывающей температуру Т 0 и давление Р 0, при которых могут сосуществовать в безвариантном равновесии одновременно три фазы.
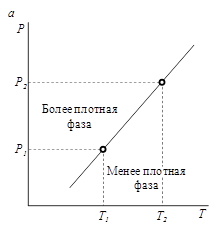

Рис. 3. Наклон кривых фазовых переходов в зависимости от соотношения плотностей фаз:
Пользуясь диаграммами состояния можно проследить за всеми изменениями свойств системы при изменении параметров ее состояния. Например, на диаграмме (см. рис. 2) видно, что при внешнем постоянном давлении Pi в точке 1 вещество находится в твердом состоянии, причем давление насыщенных паров над твердой фазой при заданной температуре равно Р тв. При нагревании вещества при заданном постоянном давлении фигуративная точка системы перемещается по горизонтальной прямой вправо, и в точке 2 происходит его плавление. Температура при этом остается постоянной, так как по правилу фаз Гиббса число степеней свободы двух фаз S = l + l – 2 = 0 до тех пор, пока одна из фаз полностью не превратится в другую, в данном случае твердая в жидкую. Далее от точки 2 до точки 4 нагревается жидкая фаза, при этом непрерывно возрастает по линии ОК давление ее насыщенного пара. В точке 3 его величина равна Р ж, а в точке 4 становится равным внешнему давлению Pi. При температуре, отвечающей точке 4, начинается и заканчивается (F = 0) кипение жидкости, после чего остается одна фаза – газ, система приобретает одну степень свободы, температура газа растет. Линия испарения ОК на диаграмме обрывается в критической точке K, которой соответствуют критические параметры: критическое давление Р кр и критическая температура Т кр.
При охлаждении пара при том же постоянном давлении Pi в точке 4 происходит его конденсация, далее охлаждается жидкость, которая в точке 2 должна закристаллизоваться или перейти в метастабильное состояние в виде переохлажденной жидкости с последующей ее кристаллизацией.
 2015-07-04
2015-07-04 3125
3125
