Пример 1.
Фазовые равновесия в двухкомпонентных системах
Общие понятия и определения
Свойства двухкомпонентных (K = 2) систем определяются тремя независимыми переменными: давлением Р и температурой Т (внешние переменные), а также составом системы при условии его выражения в массовых или мольных долях (процентах). В связи с этим диаграммы состояния таких систем должны быть объемными, построенными в трех измерениях: Р, Т, состав системы (рис. 13).
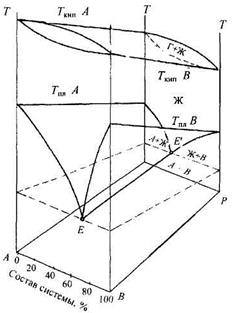
Рис. 13. Объемная диаграмма состояния двухкомпонентной системы.
Несмотря на то, что объемная диаграмма дает полную информацию о влиянии всех параметров на свойства двухкомпонентных систем, она неудобна. Поэтому для ее изображения на плоскости рассматривают различные проекции сечений диаграммы на плоскость: либо при постоянном давлении в координатах температура – состав (изобарические сечения), либо при постоянной температуре (изотермические сечения) в координатах давление - состав (рис. 14).
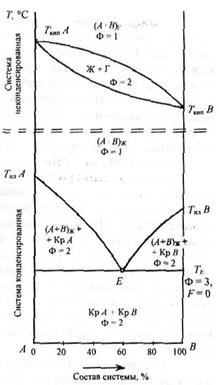
Рис. 14. Проекция изобарического сечения диаграммы состояния двухкомпонентной системы.
Далеко не всегда при изучении двухкомпонентных систем требуется исследовать полную диаграмму состояния. Как правило, в одних случаях исследуются только процессы кристаллизации и плавления, в других - только процессы конденсации и испарения. В связи с этим диаграмму условно разделяют на две части: неконденсированную систему (газ - жидкость) при относительно высоких температурах, при которых твердые фазы отсутствуют, и конденсированную систему (жидкость - кристаллы твердых фаз), в которой газа уже нет.
При изучении диаграмм состояния конденсированных систем обычно исследуют только изобарические сечения: либо одно при заданном постоянном давлении, либо несколько при различных давлениях, если помимо температуры и состава системы требуется изучить также влияние давления.
Основное уравнение, описывающее гетерогенные фазовые равновесия – уравнение правила фаз Гиббса – записывается в следующем виде:
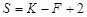 ,
,
где S – число степеней свободы системы, т.е. число параметров состояния, которые можно изменять в определенных пределах без изменения фазового состава системы; K – число компонентов системы, т.е. минимальное число составных частей системы, необходимое для ее полного описания; F – количество фаз системы, т.е. число ее гомогенных частей, разделенных между собой поверхностями раздела.
Одним из простейших частных случаев диаграмм состояния является изображение системы с полной растворимостью компонентов в обеих равновесных фазах. Следует отметить, что внешний вид и общие принципы чтения таких диаграмм состояния одинаковы как для конденсированных, так и для неконденсированных систем (рис. 15). При анализе таких диаграмм на них надо, прежде всего, выделить гомогенные области, т.е. зоны существования непрерывных фаз: твердых, жидких или газообразных растворов.
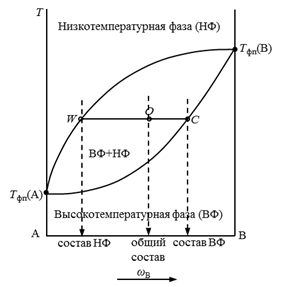
Рис. 15. Изобарическая диаграмма состояния двухкомпонентной системы с неограниченной растворимостью веществ.
Выше верхней линии (для равновесий «твердое тело – жидкость» она называется линией ликвидуса, а для равновесий «жидкость – пар» – линией газа или линией конденсации), выражающей зависимость состава высокотемпературной фазы от температуры равновесия, расположена более высокотемпературная фаза. Для равновесий «жидкость – пар» – это пар, а для равновесий «твердое тело – жидкость» – жидкость.
Ниже нижней линии (для равновесий «твердое тело – жидкость» она называется линией солидуса, а для равновесий «жидкость – пар» – линией жидкости или линией испарения), выражающей зависимость состава низкотемпературной фазы от температуры равновесия, расположена более низкотемпературная фаза. Для равновесий «жидкость – пар» – это жидкость, а для равновесий «твердое тело – жидкость» – твердое тело.
Прямая линия, соединяющая составы равновесных фаз на диаграмме, называется нодой. Абсциссы точек пересечения ноды с обеими линиями указывают составы равновесных фаз.
 2015-07-04
2015-07-04 2870
2870








