Введение
При изучении свойств гетерогенных систем широко используется метод, получивший название физико-химический анализ и основанный на графическом изображении зависимости между составом и свойствами системы с помощью диаграммам состояния. В большинстве случаев они строятся по экспериментальным данным (например, по кривым охлаждения) с применением специальной техники исследования и позволяют изучать до 140 различных физических и химических свойств системы.
Наиболее распространены диаграммы состояния, характеризующие зависимость между исходным составом систем и температурой фазовых превращений, протекающих в этих системах. Изучение подобных диаграмм позволяет легко определить взаимную растворимость компонентов системы в различных агрегатных состояниях, наличие у них полиморфных превращений, состав и свойства химических соединений, образованных компонентами, температуру и давление всех фазовых превращений в системах заданного состава, изменение состава и относительного количества находящихся в равновесии фаз при изменении температуры или давления, выбрать состав наиболее легкоплавкой или тугоплавкой системы и т.д.
Наглядность и высокая информативность диаграмм состояния обусловили их широкое применение в прикладных науках: химической технологии, петрологии, минералогии, гидрогеологии, металлургии, металловедении.
Основные понятия и определения
Гетерогенной (неоднородной) называется термодинамическая система, состоящая из нескольких фаз, между которыми имеются видимые границы раздела. Фаза – совокупность гомогенных частей системы, одинаковых по составу, физическим и химическим свойствам, и отделенных от других частей системы поверхностью. Каждая фаза может содержать одно или несколько составляющих веществ. Составляющее вещество – любое вещество, которое может быть выделено из системы и существовать вне ее. Следует различать понятия составляющее вещество и компонент системы.
Компоненты системы (независимые составляющие вещества) – составляющие ее вещества, концентрации которых в данной системе могут быть выбраны произвольно без изменения числа фаз системы. Посредством компонентов системы полностью можно ее вещественный и фазовый состав.
Число компонентов системы – наименьшее число составляющих веществ, достаточное для определения состава любой фазы системы. Число компонентов (К) равняется числу составляющих веществ системы (С.В.) за вычетом числа уравнений (У), связывающих концентрации этих веществ на момент равновесия:
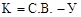 .
.
Таким образом, число компонентов системы или совпадает с числом составляющих веществ или меньше его.
Если между составляющими веществами отсутствует химическое взаимодействие, то уравнений связи нет и число компонентов равно числу составляющих веществ
Если в системе протекает химические реакции, то количества составляющих веществ зависят друг от друга и состав системы можно определить по содержанию лишь части составляющих систему веществ, т.е. по компонентам системы.
Пример 1. При протекании гомогенной реакции образования йодистого водорода 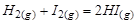 составляющие вещества равновесной системы (H2, I2 и HI) связаны между собой уравнением баланса масс:
составляющие вещества равновесной системы (H2, I2 и HI) связаны между собой уравнением баланса масс:
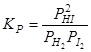 .
.
В состоянии равновесия состав системы можно описать, задав концентрацию 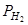 и
и 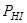 или
или 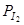 и
и 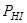 ; содержание третьего вещества всегда можно вычислить по уравнению константы равновесия. В этом случае K = 3 – 1(уравнение константы) = 2
; содержание третьего вещества всегда можно вычислить по уравнению константы равновесия. В этом случае K = 3 – 1(уравнение константы) = 2
Если поставить дополнительное условие 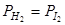 , а значит ввести дополнительное уравнение, то K = 3 – 2 = 1.
, а значит ввести дополнительное уравнение, то K = 3 – 2 = 1.
Пример 2. При образовании кристаллического хлорида аммония по уравнению реакции:
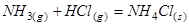 .
.
В равновесной системе число составляющих веществ равно трем.
Концентрации аммиака и хлороводорода связаны уравнением баланса масс:
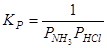 .
.
В этой ситуации число компонентов системы K = 3 – 1 = 2.
При термическом разложении кристаллического хлорида аммония по реакции
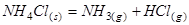 .
.
В равновесной системе будет три составляющих вещества: NH3, HCl и NH4Cl. Концентрации газообразных веществ связаны уравнением баланса масс
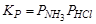
и равенством давлений хлороводорода и аммиака, которое определяется уравнением реакции: 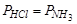 .
.
В этом случае система будет однокомпонентной и K = 3 – 2 = 1.
По числу компонентов различают диаграммы состояния одно-, двух-, трех- и т. д компонентных систем.
Важной характеристикой любой термодинамической системы является ее число степеней свободы, т.е. число независимых переменных (давление, температура, состав), которые можно свободно менять в определенных пределах и при этом количество и природа фаз останутся без изменений.
Число степеней свободы определяется правилом фаз Гиббса:
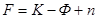 ,
,
где п – количество параметров состояния системы, изменение которых приводит в определенных условиях к изменению фазового состава системы.
Правило фаз Гиббса является наиболее общим и точным законом, определяющим условия равновесия в гетерогенной системе. Число фаз всегда меньше суммы числа компонентов и внешних сил (параметров): 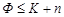 .
.
Число степеней свободы равновесной термодинамической системы, на которую влияют только температура и давление (n = 2) определяется уравнением:
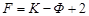 .
.
Если в число внешних факторов входит либо температура Т, либо давление Р, то
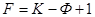 .
.
Если число степеней свободы F = 0, то такая система называется безвариантной или инвариантной. Безвариантной системе соответствует максимально возможное количество фаз, находящихся в равновесии.
Если число степеней свободы F = 1, то такая система называется моновариантной; в ней возможно изменение только одного параметра.
Правило фаз позволяет:
1) определить возможное число степеней свободы системы с заданным числом компонентов в зависимости от числа находящихся в равновесии фаз,
2) вычислить максимальное число фаз, которое может находиться в равновесии в данной системе и соответствует безвариантному состоянию (F = 0) и, следовательно, все параметры состояния системы (состав, температура и давление) имеют строго определенные фиксированные значения.
 2015-07-04
2015-07-04 4234
4234
