Явление ограниченной растворимости компонентов в твердом состоянии связано с образованием твердых растворов внедрения. Такие растворы образуются при внедрении одного из компонентов в кристаллическую решетку другого, называемого в этом случае «хозяином» кристаллической решетки твердого раствора. Такого типа твердые растворы образуются между компонентами, имеющими различные параметры кристаллических решеток и структурных элементов, и могут быть только ограниченными. Диаграммы состояния с образованием растворов внедрения бывают эвтектического (рис. 30) и перитектического (рис. 31) типов.
Линии ликвидус на этих диаграммах (соответственно ТА-Е-TB и TA-P-ТB) показывают температуру начала кристаллизации и изменение состава жидкой фазы, из которой кристаллизуются твердые фазы. Компоненты не кристаллизуются из расплава в чистом виде, а образуют ограниченные твердые растворы: у раствора α «хозяин» кристаллической решетки - компонент А, у раствора β -компонент В. Иначе говоря, α - это твердый раствор компонента В в А, а β - твердый раствор А в В.
Растворимость компонентов друг в друге в твердом состоянии ограничена линиями растворимости. Растворимости компонента В в А соответствует линия TA-M-m; линия насыщенного раствора А в В – TB-N-n. Различия в химических и кристаллографических свойствах приводят к появлению экстремальной точки Е, сходной со своему характеру с точкой эвтектики (рис. 30). Компоненты системы (рис. 31) имеют свойства, близкие к идеальным, а на линиях ликвидус и солидус отсутствуют экстремальные точки.
По линиям солидус диаграмм (ТА-М-N-TB)можно проследить изменение составов твердых растворов α и β, находящихся в равновесии с насыщенной ими жидкой фазой, а также температуру конца кристаллизации.
Линии Mm и Nn показывают влияние температуры на взаимную растворимость компонентов в насыщенных твердых растворах, находящихся в равновесии в области диаграмм, расположенной между этими линиями. На изотермах диаграмм находятся в безвариантном равновесии (F = 0) три фазы.
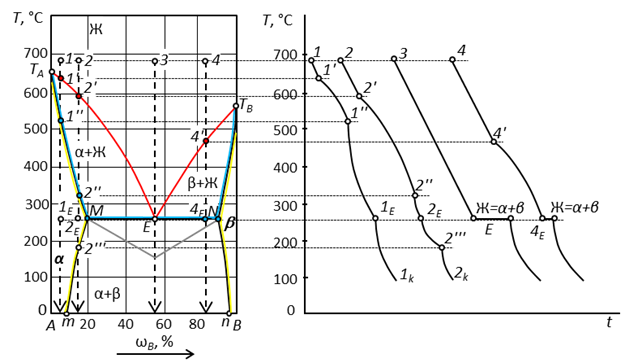
Рис. 30. Диаграмма состояния двухкомпонентной конденсированной системы с образованием твердых растворов внедрения эвтектического типа.
На изотерме диаграммы (рис. 30), из жидкой фазы, имеющей состав, отвечающий точке двойной эвтектики Е,совместно кристаллизуются твердые растворы α и β. При этой температуре заканчивается кристаллизация системы. В точке эвтектики взаимодействие фаз протекает по схеме 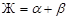 . На части линии эвтектики, ограниченной точками МЕ реализуется равновесие
. На части линии эвтектики, ограниченной точками МЕ реализуется равновесие 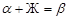 , т.е. к процессу кристаллизации твердого раствора α добавляется кристаллизация твердого раствора β. На линии EN кристаллизация описывается уравнением
, т.е. к процессу кристаллизации твердого раствора α добавляется кристаллизация твердого раствора β. На линии EN кристаллизация описывается уравнением 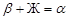 , указывающим, что вначале шла кристаллизация твердого раствора β (см. путь кристаллизации и кривую охлаждения точки 4). Продолжительность температурных остановок на кривых охлаждения определяется по треугольнику Таммана. Ниже этой температуры остаются два твердых раствора, составы которых при дальнейшем понижении температуры меняются по соответствующим линиям растворимости.
, указывающим, что вначале шла кристаллизация твердого раствора β (см. путь кристаллизации и кривую охлаждения точки 4). Продолжительность температурных остановок на кривых охлаждения определяется по треугольнику Таммана. Ниже этой температуры остаются два твердых раствора, составы которых при дальнейшем понижении температуры меняются по соответствующим линиям растворимости.
Изменение состава твердого раствора приводит к замедлению процесса охлаждения, что показано вогнутыми линиями на кривых охлаждения точек 1 и 2. Отсутствие монотонности кривых охлаждения на участках 1''-1 Е и 1 Е -1 k, а также на участках 2''-2 Е и 2 Е -2''' объясняется увеличением концентрации компонента В в составе твердого раствора α до температуры эвтектики и последующим ее уменьшением. Изменение фазового состава в поле совместного существования двух твердых растворов (α + β) также сопровождается замедлением кристаллизации, что показано вогнутыми линиями на кривых охлаждения.
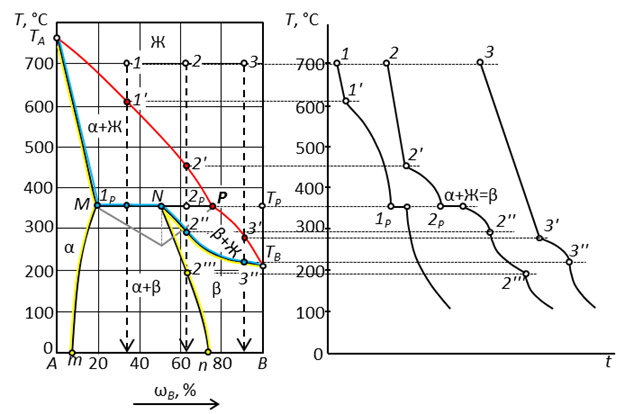
Рис. 31. Диаграмма состояния двухкомпонентной конденсированной системы с образованием твердых растворов внедрения перитектического типа.
На изотерме диаграммы (рис. 31) протекает перитектический процесс, при котором жидкая фаза, состав которой при охлаждении системы приходит в точку Р,взаимодействуя с твердым раствором α, образует твердый раствор β по фазовой реакции 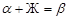 . Поскольку эта реакция обратима, при нагревании она протекает в противоположном направлении, т.е. происходит разложение твердого раствора β, что и показывает вершина треугольника Таммана, построенного на изотерме диаграммы. Характер кривых охлаждения аналогичен рис. 30: кристаллизация из жидкой фазы сопровождается экзо
. Поскольку эта реакция обратима, при нагревании она протекает в противоположном направлении, т.е. происходит разложение твердого раствора β, что и показывает вершина треугольника Таммана, построенного на изотерме диаграммы. Характер кривых охлаждения аналогичен рис. 30: кристаллизация из жидкой фазы сопровождается экзо
 2015-07-04
2015-07-04 2054
2054
