Основным медиатором мозга человека является возбуждающая аминокислота глутамат, которая служит медиатором примерно в 75% возбуждающих синапсов мозга. Важная роль глутамата в мозге человека заслуживает подробного рассмотрения глутаматергических синапсов.
Ионотропные рецепторы глутамата можно разделить на три основных подтипа. Это NMDA-, AMPA- и каинатные рецепторы. Названия подтипов основаны на том, что первые, помимо природного медиатора глутамата, могут активироваться его синтетическим аналогом – N-метил-D-аспартатом (NMDA), вторые – α-амино-З-метил-4-изоксазол-пропионовой кислотой (AMPA), а третьи - каинатной кислотой.
Эти рецепторы различаются по структуре, ионной селективности, проводимости и кинетике активации.
Рассмотрим подробнее NMDA-рецепторы. Они являются тетрамерами, состоящими из двух разных пар субъединиц. Субъединицы одной пары
связывают глутамат, а другой – взаимодействуют с глицином (рис. 32А). Глицин является аллостерическим ко-активатором NMDA-рецепторов. NMDA-рецепторы обладают значительной проницаемостью для ионов кальция и натрия, и способны находиться в активном, проводящем ионный ток состоянии, несколько сот миллисекунд. Важной особенностью NMDA-рецепторов является тот факт, что при потенциале покоя (около -70 мВ) канальные поры этих рецепторов заблокированы ионами магния. Поэтому, даже при наличии глутамата и глицина, NMDA-рецепторы не способны вызвать ни деполяризацию, не обеспечить повышение внутриклеточной концентрации кальция. Помочь освободиться от магниевого блока может только деполяризация, реализуемая, например, через AMPA-рецепторы.
AMPA-рецептор также состоит из двух пар субъединиц, которые могут быть либо одинаковыми, либо разными (рис. 32Б). Все AMPA-рецепторы пропускают одновалентные катионы, а некоторые (в зависимости от субъединичного состава) обладают также умеренной проницаемостью для кальция. В любом случае кальциевая проницаемость AMPA-рецепторов значительно ниже в сравнении с NMDA-рецепторами. Ионный канал AMPA-рецептора нечувствителен к магнию, открыт всего несколько миллисекунд и быстро переходит в состояние нечувствительности к активирующему действию глутамата. Этой относительно короткой деполяризации достаточно для того, чтобы снять магниевый блок NMDA-рецепторов.
Как правило, NMDA- и AMPA-рецепторы ко-локализованы на одном синапсе, хотя их пространственная локализация может и различаться. В первом случае при активации синапса будут возникать двухкомпонентные постсинаптические потенциалы, имеющие быстрый AMPA-зависимый и медленный NMDA-зависимый компонент (рис. 32В). Во втором случае, в зависимости от того, какие рецепторы присутствуют на постсинаптической мембране, будут возникать либо быстрые (AMPA), либо медленные(NMDA) потенциалы.
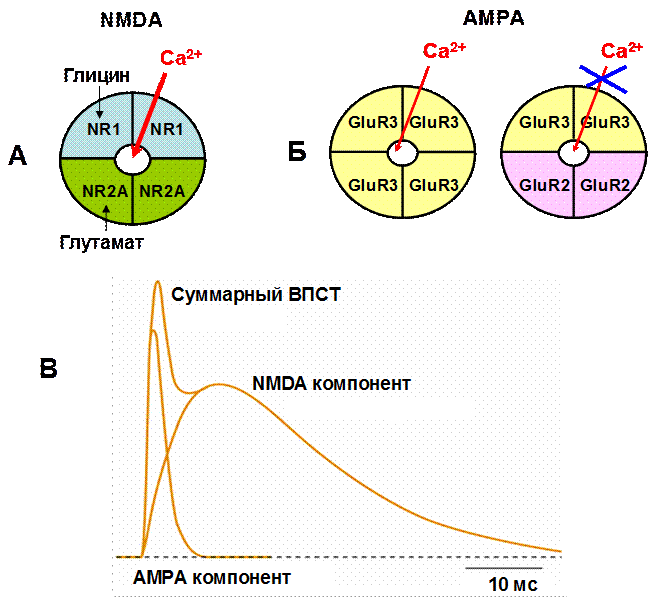
Рис. 32. Два вида рецепторов и два компонента постсинаптического ответа в глутаматергическом синапсе
На верхней части рисунка показана субъединичная организация NMDA (А) и AMPA (Б) рецепторов и их проницаемость для кальция. NMDA-рецепторы состоят из двух разных пар субъединиц, связывающих глутамат (NR2A) и глицин (NR1) и обладают значительной проницаемостью для кальция. AMPA-рецепторы, в зависимости от субъединичного состава (4 GluR3 либо 2 GluR2+2 GluR3, существуют и другие варианты) либо умеренно проницаемы, либо совсем не проницаемы для кальция. При этом все ионотропные глутаматные рецепторы пропускают моновалентные катионы. В – Суммарный возбуждающий постсинаптический ток (ВПСТ) состоит из двух компонентов. Активация AMPA-рецепторов приводит к быстрой и кратковременной деполяризации клетки (несколько миллисекунд), что снимает магниевый блок NMDA-рецепторов. Компонент, связанный с активацией NMDA-рецепторов, имеет более медленное нарастание и спад (десятки миллисекунд).
Долговременная пластичность. Уникальная способность глутаматергического синапса сохранять следы предшествующей активности на долгое время лежит в основе долговременных форм синаптической пластичности - долговременной потенциации и долговременной депрессии. Суть этих явлений состоит в том, что кратковременная активность, сопровождающаяся значительным входом кальция в нейрон, приводит к увеличению (долговременная потенциация) или уменьшению (долговременная депрессия) амплитуды постсинаптического потенциала, которое длится в течение дней, недель, месяцев и даже лет. Долговременная потенциация была открыта более 30 лет назад выдающимися физиологами Терье Ломо и Тимом Блиссом, а долговременная депрессия – чуть позднее. Долговременная пластичность синапса является клеточной формой памяти, дающей надежду понять ключевые механизмы работы мозга.
Как долговременная потенциация, так и депрессия запускаются одним и тем же фактором – ритмической активацией глутаматергического синапса. При этом сначала под действием глутамата активируются AMPA-рецепторы, которые обеспечивают деполяризацию постсинаптической мембраны. Деполяризация снимает магниевый блок NMDA-рецепторов, которые теперь способны к активации. Активированные под действием глутамата NMDA-рецепторы обеспечивают дальнейшую деполяризацию и значительный вход ионов кальция в постсинаптическую клетку.
Почему же в одном случае возникает потенциация, а в другом депрессия? Это связано с частотой активности синапса. Низкочастотная стимуляция за счет активации небольшого количества NMDA-рецепторов вызывает умеренное повышение концентрации кальция, что приводит к долговременной депрессии; напротив, высокочастотная активация вызывает более выраженную и длительную активацию большого числа NMDA-рецепторов, ведущую к значительному входу кальция в клетку и развитию потенциации. Разные уровни внутриклеточной кальциевой концентрации запускают различные внутриклеточные каскады реакций, приводящие к разнонаправленным изменениям синаптической силы, Одним из важнейших механизмов экспрессии долговременной пластичности в обоих случаях является изменение количества AMPA-рецепторов на постсинаптической мембране. Отсюда происходит увеличение или уменьшение амплитуды постсинаптического потенциала.
Помимо постсинаптических, существуют и пресинаптические механизмы долговременных форм пластичности, которые запускаются ретроградными посредниками (монооксид азота, монооксид углерода и др.). Эти посредники синтезируются в постсинаптической клетке, а затем диффундируют в пресинаптическую клетку и за счет действия на определенные белки изменяют количество освобождаемых квантов глутамата.
Исследования ионного канала NMDA-рецептора привели к неожиданным результатам, имеющим важное прикладное значение. Оказалось, что некоторые блокаторы NMDA-рецепторов являются эффективными средствами для лечения эпилепсии, ишемии и ряда нейродегенеративных заболеваний. Важным свойством таких блокаторов является то, что они ингибируют только активированные рецепторы, причем пропорционально степени их активации. Это устраняет избыточную и длительную активацию нейронов, предохраняя их от запрограммированной гибели - апоптоза. Поэтому использование блокаторов ионных каналов NMDA-рецепторов будет, по-видимому, перспективным также при лечении травм мозга и инсультов, сопровождающихся повышением уровня внеклеточного глутамата.
В медицине широко применяются такие блокаторы NMDA-рецепторов, как мемантин – для лечения болезни Альцгеймера, амантадин – для лечения болезни Паркинсона, кетамин – в качестве средства для наркоза, декстрометорфан – как противокашлевое средство, и др.
 2015-07-04
2015-07-04 1878
1878








