Молекулярность реакции – это минимальное число молекул, участ- вующих в элементарном химическом процессе. По молекулярности эле- ментарные химические реакции делятся на: молекулярные (А →) и бимо- лекулярные (А + В →); тримолекулярные реакции встречаются чрезвычай- но редко.
Если реакция протекает последовательно через несколько гомогенных или гетерогенных элементарных стадий, то суммарная скорость всего про- цесса определяется самой медленной его частью, а молекулярность заме- няется порядком реакции – формальным показателем при концентрации
реагирующих веществ. Поэтому весь процесс в целом лучше характеризу- ет порядок реакции.
При избытке одного из компонентов элементарной реакции А + В (А >> В) скорость реакции будет практически зависеть от изменения кон- центрации вещества В (А = const), поэтому порядок бимолекулярной реак- ции понижается до первого. Аналогично тому, что скорость реакции может характеризоваться по любому веществу, участвующему в реакции, для ре- акции a А + b В → кинетические уравнения по веществу А и веществу В выглядят соответственно
|
а общее кинетическое уравнение
|
V =kCx ×kCy =kC z.
A a b
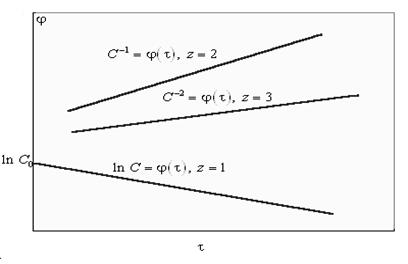
Здесь z = x + y – общий порядок реакции. Запишем кинетическое урав- нение в дифференциальной форме для разных исходных реагентов:
 -dC =kC2.
-dC =kC2.
dt
Разделение переменных и интегрирование в пределах от нуля до τ дает приведенные в табл. 1.1 уравнения для реакций первого, второго и третье- го порядков.
Таблица 1.1
|
 0
0
 1 1 2
1 1 2
|



 2 τ çС С ÷
2 τ çС С ÷

 1 2 С × k
1 2 С × k


 3 τ çС2
3 τ çС2
С2 ÷
1 2 С2 × k
|
Рис. 1.1. Зависимости C = f (τ) для реакций первого, второго и третьего порядков
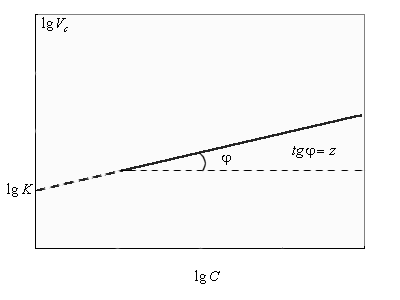
Прологарифмировав уравнение (1), получим lgV = lgK + z lgC. Из гра- фической зависимости (см. рис. 1.1) получаем lg K и z = tg φ (рис. 1.2).
Порядок реакции, особенно гетерогенной, может быть не только цело- численным (в том числе и нулевым), но и дробным. Нулевой порядок ре- акции указывает на постоянство скорости во времени.
Для гетерогенной реакции C(тв) + О2(г) = СО2(г) можно создать концен- трационные условия, при которых порядок реакции будет меняться в пре- делах от нуля до единицы. Действительно, при больших парциальных дав-
лениях кислорода
P в приповерхностном слое твердого углерода большой
|
концентрационный градиент способствует практически мгновенному вос-
полнению прореагировавшего кислорода. Следствием этого оказывается
постоянство скорости реакции по кислороду, поскольку
C ~ const. По-
|
этому реакция горения углерода будет в этих условиях подчиняться кине- тическому уравнению нулевого порядка. При уменьшении парциального
давления кислорода, начиная с некоторого
P скорость реакции будет со-
|
ответствовать кинетическому уравнению первого порядка
 dc =-KC.
dc =-KC.
dt O2
|
Рис. 1.2. Зависимость V = f (lg C)
При анализе процесса горения первостепенное значение имеет изуче- ние факторов, определяющих инициирование и скорость химических пре- вращений [4, 5].
Для протекания процесса горения необходимым условием является на- личие смеси реакционноспособных веществ, содержащей горючее и окис- литель.
В химическую реакцию может вступать только «активная» частица го- рючей смеси, обладающая к моменту вступления в реакцию достаточным запасом энергии. Энергия, достаточная для необходимого сближения реа- гирующих частиц, называется энергией активации Е0.
В реакцию могут вступать только активные молекулы (атомы, радика- лы), то есть те, которые в момент соударения обладают энергией, превы- шающей энергию активации реакции. Доля активных молекул возрастает при увеличении температуры горючей смеси.
Зависимость скорости реакции от температуры описывается уравнени- ем Аррениуса:
U =Ae
E
- 0
RT,
где А – коэффициент, учитывающий частоту соударений; е – основание натуральных логарифмов; Е0 – энергия активации; R – универсальная га- зовая постоянная; Т – температура горючей смеси.
Однако на практике любая реакция горения может иметь одновременно признаки и теплового и цепного механизма протекания реакции. Зарожде- ние первых активных центров может иметь тепловой характер, а реагирова- ние активных частиц по цепному механизму приводит вновь к выделению тепла, разогреву горючей смеси и термическому зарождению новых центров.
Тепловое самовоспламенение. Тепловой эффект реакций частично идет на нагревание горючей смеси, частично теряется в окружающую сре- ду. После предварительного нагрева горючей смеси и достижения такого состояния, когда приход тепла в результате реакции станет выше отвода тепла из зоны реакции, – начинается самоускорение реакции.
Чем больше давление (или концентрация газовой смеси), тем больше будет скорость реакции и, следовательно, будет больше теплоприход. А скорость теплоотвода не зависит от давления. Дальнейшее повышение давления приведет к повышению температуры и возникновению самовос- пламенения.
Автокаталитически-тепловое самовоспламенение. Катализатор хи- мической реакции – вещество, ускоряющее химическую реакцию, но не меняющее после реакции свое состояние:
А + В = АВ – идет очень медленно; А + К = АК, АК + В = АВ + К;
А + В + (К) = АВ + К.
Примером такого катализа реакции служит нитрозный способ получе- ния серной кислоты:
 2SO2 + O2 + 2H2O = 2H2SO4 – идет очень медленно, но в присутствии окиси азота;
2SO2 + O2 + 2H2O = 2H2SO4 – идет очень медленно, но в присутствии окиси азота;
2NO + O2 = 2NO2
2NO2 + 2SO2 + 2H2O = 2H2SO4 + 2NO
быстро идущие реакции.
Явление, при котором каталитическое действие на реакцию оказывает какой-либо из продуктов, называется автокатализом (для начала обычно нужна «затравка»).
Вещества, которые замедляют протекание реакции, называют отрица- тельными катализаторами или ингибиторами реакции. Например, хладоны (предельные галогенуглеводороды), применяемые для тушения пожаров.
Цепное самовоспламенение имеет природу, отличную от теплового (выделение тепла происходит в результате разветвления реакционных це- пей и накопления химически активных частиц, как правило, радикалов).
Любая цепная реакция складывается из элементарных стадий зарожде- ния, продолжения и обрыва цепи. Зарождение цепей является экзотерми- ческой реакцией. Образование свободных радикалов возможно в результа- те моно- или бимолекулярных взаимодействий, а также в результате ини- циирования (добавке инициаторов, ионизация, действие света).
К реакциям продолжения цепи относятся элементарные стадии цепной реакции (существует четыре типа).
В любом цепном процессе должна быть, по крайней мере, одна стадия, в которой расходуется исходное вещество, и одна стадия, в которой обра- зуются продукты реакции.
Обрыв цепи – исчезновение свободных радикалов. Пример разветв- ленной цепной реакции (реакция окисления Н2):
H2 +O2 ®
2OH ·(зарождение цепи);
OH ·+H2 ®H2O +
H ·(продолжение цепи);
· · ··
H+O2 ®OH+O,
O+H2 ®OH·+H (разветвления цепи);
· ·
·
H+H+стенка ®H2
· ·
(обрыв цепи на стенке);
H+O2 ®HO2 +
M
(обрыв цепи в объеме),
где М – молекула любого вещества, не участвующего в реакции.
Краткий сравнительный анализ трех механизмов самоускорения реак- ций горения позволяет кратко сформулировать:
· тепловое самоускорение реакции происходит вследствие саморазо- грева горючей смеси за счет выделяющегося при реакции тепла;
· автокаталитически-тепловое самоускорение происходит в результа- те накопления продуктов реакции катализирующих превращение исходно- го вещества. Когда достигается перевес прихода тепла над его отводом, наступает тепловое самоускорение, заканчивающееся взрывом;
· цепное самоускорение реакции при постоянной температуре происхо- дит в результате превышения разветвления над обрывом цепи, когда обра- зуется достаточное количество активных центров, способствующих разви- тию цепного характера реакции.
Но большинство процессов горения осуществляется по комбинирован- ному механизму реакции.
Теория цепных реакций. Цепные реакции, химические и ядерные ре- акции, в которых появление промежуточной активной частицы (свободного радикала, атома или возбужденной молекулы – в химических, нейтрона – в ядерных процессах) вызывает большое число (цепь) превра- щений исходных молекул или ядер вследствие регенерации активной час- тицы в каждом элементарном акте реакции (в каждом звене цепи).
В изученных неразветвленных химических цепных реакциях активные центры – свободные атомы и радикалы, способные легко, с малой энергией активации реагировать с исходными молекулами, порождая наряду с молекулой продукта также новый активный центр. В разветвленных хими- ческих цепных реакциях в качестве активных центров могут выступать также возбужденные молекулы, а в вырожденно-разветвленных реакциях – также нестабильные молекулы промежуточных веществ.
Неразветвленные цепные реакции. Химические процессы с нераз-
ветвленными цепями можно рассмотреть на примере фотохимической ре- акции между водородом и хлором. В этой цепной реакции молекула хлора, поглощая квант света, распадается на два атома. Каждый из образовавших- ся атомов хлора начинает цепь химических превращений; в этой цепи атомы хлора и водорода выступают в качестве активных частиц. Длина це- пи может быть очень большой – число повторяющихся элементарных ре- акций продолжения цепи на один зародившийся активный центр может достигать десятков и сотен тысяч. Обрыв цепей происходит в результате рекомбинации атомов в объеме реактора, захвата атомов его стенкой с по- следующей рекомбинацией на стенке, образования неактивного радикала при реакции активных центров с молекулами всегда присутствующих примесей.
Реакцию между H2 и Cl2, вызванную действием кванта света hυ, мож- но представить схемой:
Cl2 +hn®2Cl
– зарождение цепи
Cl +H2 ®HCl +H ü
ý– продолжение цепи
H +Cl2 ®HCl +Clþ
 Cl +стенка ®1 Cl ü
Cl +стенка ®1 Cl ü
2 2 ï
ï
Cl +Cl +M ®Cl2 +M
ý– обрыв цепи
ï
H +O2 +M ®HO2 +Mï
þ
В последних двух стадиях М – любая третья частица (атом или молекула), которая нужна для того, чтобы отнять часть энергии у обра- зующихся частиц Cl2 и HO2 и тем самым сделать невозможным их обрат- ный распад.
Скорость цепных реакций чрезвычайно чувствительна к скоростям за- рождения и обрыва и поэтому зависит от наличия химических примесей, от материала и состояния стенок реакционного сосуда, а также от его раз- мера и формы.
По неразветвленно-цепному механизму протекает большое число прак- тически важных реакций, в частности хлорирование, ряд реакций жидко- фазного окисления органических соединений, термический крекинг. Свое- образным процессом с неразветвленными цепями является также полимеризация, при которой цепь реакций одновременно определяет и длину полимерной молекулы.
Концепция неразветвленных цепных реакций возникла в результате ра- бот немецкого ученого М. Боденштейна обнаружившего, что в ряде фотохимических реакций один поглощенный квант света вызывает пре- вращение многих молекул. В частности, при образовании HCl из H2 и Cl2 в среднем на каждый поглощенный квант образуется до 1 000 000 молекул HCl. Поскольку один квант может активировать только одну молекулу, ос- тальные вступают в реакцию без непосредственного воздействия света. Механизм этой реакции предложил В. Нернст в 1916 г. Современная тео- рия реакций с неразветвленными цепями была создана и развита школой Боденштейна, а также трудами советских ученых.
Реакции с разветвленными цепями. Совершенно особыми свойства- ми обладают реакции, в которых цепи разветвляются. Эти реакции были обнаружены в 1926 г. группой ленинградских физиков на примере
окисления паров фосфора. Было установлено, что при малом изменении какого-либо параметра реакционной системы (концентрации реагентов, температуры, размера сосуда, примесей специфических веществ) и даже при разбавлении инертным газом практически незаметная реакция скачко- образно переходит в быстрый, самоускоряющийся процесс типа самовоспламенения.
Н.Н. Семеновым с сотрудниками впервые было дано объяснение этого парадоксального факта и создана количественная теория разветвленных цепных реакций. Значительный вклад в развитие представлений о разветв- ленных цепных реакций внесли также работы С.Н. Хиншелвуда с сотруд- никами по изучению верхнего предела воспламенения. За исследования механизма химических реакций Семенову и Хиншелвуду была присуждена в 1956 г. Нобелевская премия.
В ходе разветвленных цепных реакций при взаимодействии одного из активных центров возникает более чем один (часто – три) новый активный
центр, т. е. происходит размножение цепей. Примером разветвленной цепной реакции может служить окисление водорода, где разветвление и продолжение цепей происходит по схеме:
(1) Н + O2 → OH + О – разветвление
(2)OH + H2 ® H 2O + H (3)O + H2 ® OH + H
ü
ï
ý – продолжение
ï
(2a)OH +H2 ®H2O +Hþ
или в сумме Н + 3H2 + O2 = 2H2O + 3H.
Наряду с образующимися в реакциях 1–3 активными центрами Н и OH, обеспечивающими развитие неразветвленной цепи, в реакции (1) образует- ся атом кислорода, формально обладающий двумя свободными валентностями и способный легко входить в реакцию (3) с образованием Н и OH – еще двух носителей цепей. Такой тип разветвления был назван ма- териальным.
В реакциях с энергетическим разветвлением размножение цепей осу- ществляется за счет возбужденных частиц – продуктов экзотермических реакций развития цепи.
Скорость разветвленно-цепного процесса в газовой фазе в начальных стадиях выражается формулой
W =k[A]
w0
 f -g
f -g
e(f -g) t
где k – константа скорости реакции активного центра с исходным веществом, [А] – концентрация исходного вещества, ω0 – скорость зарож- дения цепей, f и g – соответственно эффективные константы скорости раз- ветвления и обрыва, e – основание натурального логарифма, t – время.
В условиях, когда (f – g) > 0, концентрация активных центров и ско- рость W растут лавинообразно во времени. Если же (f – g) < 0, то концентрации активных центров и соответственно скорость реакции очень малы, так как мала скорость зарождения цепей ω0. Переход от одного ре- жима реакции к другому осуществляется практически скачком при крити- ческом условии (f – g) = 0.
Скорость разветвления цепей пропорциональна концентрации молеку- лярного реагента, вступающего в эту реакцию с активным центром. В то же время скорость гетерогенного обрыва цепей на стенке сосуда в зависи- мости от состояния его поверхности может не зависеть от концентрации
или уменьшаться с ростом концентрации газофазной смеси. Поэтому при повышении давления, начиная с определенного его значения (первый пре-
дел), f становится больше g и происходит самовоспламенение смеси. Если обрыв цепей протекает при тройных столкновениях, то его скорость про- порциональна произведению суммарной концентрации смеси и концентрации исходного реагента, образующего с активным центром ма- лоактивный радикал. При дальнейшем повышении давления, начиная с оп- ределенного его значения (верхний предел), обрыв превалирует над раз- ветвлением (f < g), и воспламенения не происходит. Давление, при кото- ром f = g, называется критическим давлением.
По аналогичным причинам для разветвленных цепных реакций суще- ствует и критическая температура самовоспламенения. Поскольку ско- рость разветвления зависит от температуры сильнее, чем скорости обрыва, с повышением температуры область воспламенения расширяется.
Разветвленные цепные реакции – это не только химические и ядерные реакции. Явление когерентного излучения лазера, например, также отно-
сится к числу разветвленных цепных процессов.
Вырожденно-разветвленные цепные реакции. При развитии нераз- ветвленных цепей часто образуется промежуточный молекулярный продукт типа перекисей, который сравнительно легко, но все же не слишком быстро распадается на свободные радикалы, начинающие дополнительные новые цепи. В этом случае имеет место сильно запаздывающее разветвление и идет медленная автоускоряющаяся реакция, названная вырожденно- разветвленной. Такие реакции сопровождаются продолжительным, иногда часовым периодом индукции (периодом скрытого автоускорения). К ним относится окисление углеводородов и многих других органических соеди- нений.
Многим вырожденно-разветвленным реакциям в газовой и в жидкой фа- зах также свойственны предельные (критические) явления, но проявляются
они не столь часто, как в обычных разветвленных цепных реакциях. Свое- образные реакции типа вырожденно-разветвленных протекают и в твердых телах, например при медленном термическом разложении кристаллов перхлората аммония. В кристаллах непосредственное разложение исходных веществ крайне затруднено и начинается на дефектах, прежде всего на дислокациях, вдоль которых образуются конечные вещества – газы или твердые продукты. При реакциях в дислокациях возникают механические напряжения, порождающие новые дислокации, т. е. идет их размножение, которое можно уподобить вырожденно-разветвленной цепной реакции.
Открытие разветвленных и вырожденно-разветвленных цепных реакций имело исключительно большое значение для создания теории процессов горения. Было доказано, что существуют только два типа воспламенения: цепное и тепловое. Теория цепных процессов лежит в основе управления
процессами горения и играет большую роль в различных областях совре- менной техники.
 2015-07-04
2015-07-04 1315
1315