Рассмотрим идеальную газовую неравновесную систему
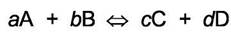
|
Начальные парциальные давления 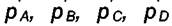 отличаются от
отличаются от
равновесных давлений без штрихового индекса. Сумма парциальных давлений равна p и не изменяется. Запишем изменение свободной энергии Гиббса системы при превращении «а» молей А и «b» молей В в продукты, т. е. в «с» молей С и «d» молей D в результате реакции при постоянной температуре Т и неизменных парциальных давлениях. Это
возможно при очень большой системе. Учитывая, что 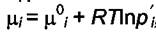 ,
,
получим
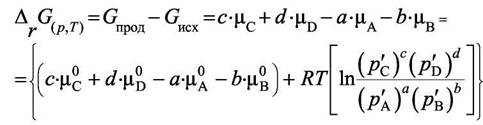
|
Комплекс под логарифмом обозначим через 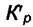 и тогда запишем
и тогда запишем
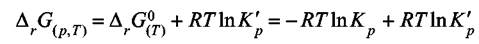 (7.12)
(7.12)
Уравнение (7.12) называется уравнением изотермы химической
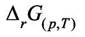
|
| реакции. |
- изменение свободной энергии Гиббса при
превращении "а" молей вещества А и "b" молей вещества В в продукты, в условиях постоянства всех парциальных давлений, равных начальным давлениям. В указанных условиях химического превращения при p = const и Т = const величина 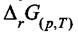 равна максимальной работе химического
равна максимальной работе химического
превращения.
Такие же выражения можно получить длядля гетерогенных
равновесий и равновесий в растворах. 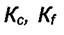
Чем больше 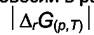 , тем дальше система от равновесия. Для
, тем дальше система от равновесия. Для
равновесия 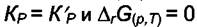 . Таким образом, величина
. Таким образом, величина 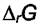 является
является
мерой отклонения системы от равновесия. Численно 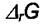 представляет собой максимальную полезную работу реакции, а величина
представляет собой максимальную полезную работу реакции, а величина 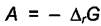 называется сродством химической реакции. Величина
называется сродством химической реакции. Величина 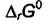 тоже
тоже
 2015-07-04
2015-07-04 377
377








