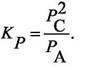
Сумма молей в равновесии 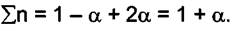 Мольные доли "А"
Мольные доли "А"
и "С" в равновесной смеси равны:
| а парциальные давления |
| Тогда константа равновесия примет вид |
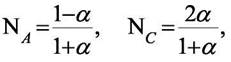
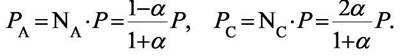
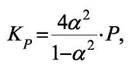
А степень превращения при переходе к равновесию (степень диссоциации) будет зависеть от общего давления в системе
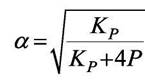
В формулу для КР входит общее давление Р и величина α, а они взаимозависимо так изменяются, что константа равновесия остаётся постоянной (Т = const, идеальные газы).
Задание. Разобрать влияние добавки инертного газа на положение равновесия в двух случаях 1) при V = const, 2)при Р = const.
Другой механизм действия давления - это отклонения от идеального поведения газов с ростом давления. В этом случае константа равновесия КР начинает зависеть от давления. Для реальных газов зависимость химического потенциала от давления записывается через летучесть
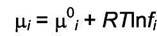
|
где 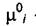 - не зависит от давления и состава смеси,
- не зависит от давления и состава смеси, 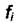 - зависит и от давления и от состава смеси,
- зависит и от давления и от состава смеси, 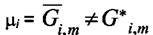
Повторив все действия и рассуждения параграфа 7.2 для идеальных газов, получим результат для реальных газов в виде
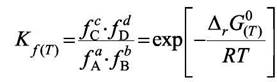
|
(7.10)
Величина 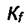 зависит только от температуры и не зависит от давления. Вся сложность взаимодействия молекул в смеси газов перенесена на определение парциальной летучести
зависит только от температуры и не зависит от давления. Вся сложность взаимодействия молекул в смеси газов перенесена на определение парциальной летучести 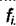 Если предположить
Если предположить
справедливость физической модели, когда взаимодействие между молекулами компонента "Г такое же, как между молекулами "i" и остальными компонентами, то
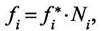
|
(7.11)
где 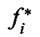 - летучесть чистого компонента при давлении, равном общему
- летучесть чистого компонента при давлении, равном общему
давлению смеси, 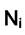 - мольная доля компонента. Формула (7.11) носит название правила Льюиса.
- мольная доля компонента. Формула (7.11) носит название правила Льюиса.
 2015-07-04
2015-07-04 424
424








