Если компоненты А и В жидкой смеси обладают близкими свойствами (сходное строение молекул и близкие молекулярные массы, одинаковая полярность и т.д.), то можно считать одинаковыми и силы взаимодействия F между их молекулами, т.е.
FA-A = FB-B = FA-B (4)
Смешение таких компонентов не сопровождается ни изменением объема (DV = 0), ни тепловым эффектом (D H=0) при условии, что изменение состава раствора не приведет к образованию новой фазы. Такие растворы называются идеальными. К ним можно отнести смеси оптических изомеров.
Идеальные растворы подчиняются закону Рауля:
P A= P0, А×NA; PB= P0, В × NB; (5)
PA и PB – давление насыщенного пара компонентов над раствором,
P0,А и P0,В- давление пара чистых компонентов,
NA и NB – мольные доли компонентов А и В в растворе.
NA= nа /(nA+nB); NB= nв/(nа+nв); NA+NB=1,0; (6)
Общее давление пара над раствором равно:
P= PA+PB (7)
Для идеальных растворов зависимость общего давления пара над раствором и парциальных давлений компонентов от состава раствора имеет линейную зависимость, что следует из рисунка 1.
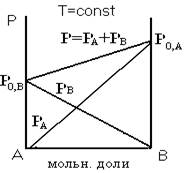
Рисунок 1 – Фазовая диаграмма давление-состав для идеальных растворов
Отклонения от идеальности обусловлены как физическими, так и химическими причинами (диполь-дипольные взаимодействия, поляризация, влияние водородных связей и вызываемые этими причинами ассоциация, диссоциация и сольватация). Отклонения давления пара от линейной зависимости в сторону больших значений принято называть положительными, а отклонения в сторону меньших значений – отрицательными. Если FA-A <FA-B> FB-B, то процесс растворения сопровождается выделением тепла (DН <0), уменьшением объёма (DV<0) и образованием ассоциатов. Такие растворы закипают при более низких давлениях, чем чистые компоненты и обладают отрицательным отклонением от закона Рауля.
Если FA-A> FA-B < FB-B,то процесс растворения является эндотермическим (DН>0), сопровождается увеличением объема (DV>0) и диссоциацией молекул. Такие растворы закипят при более высоком давлении, чем чистые компоненты и имеют положительные отклонения от закона Рауля.
 2015-07-04
2015-07-04 2014
2014
