В молекулярно-кинетической теории пользуются моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным, а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу.
Хаотическое движение молекул связано с тепловым состоянием тела. В процессе движения молекулы газа ударяются о стенки сосуда. Из-за множества молекул ограждающие газ поверхности воспринимают их удары как действие непрерывной, постоянной и нормально направленной силы. Отнесенная к единице площади сила представляет собой давление газа. На величину давления не влияет ориентация поверхности, на которую давит газ. Обусловлено это беспорядочностью теплового движения молекул, при котором ни одно из направлений не имеет преимущества. Таким образом, давление есть результат силового действия молекул на стенки сосуда. Следует ожидать, что сила удара, а значит, и давление зависят от скорости или кинетической энергии поступательного движения молекул.
Основное уравнение кинетической теории выражает зависимость давления от концентрации молекул идеального газа, от среднего значения кинетической энергии теплового движения молекул.
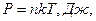
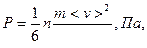
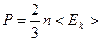 ,Па В молекулярно-кинетической теории пользуются моделью идеального газа, согласно которой считают, что:
,Па В молекулярно-кинетической теории пользуются моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным, а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу.
где <Ек> — средняя кинетическая энергия поступательного движения молекул газа, Дж; n – концентрация молекул; k – постоянная Больцмана; T – абсолютная температура; <v> - средняя квадратичная скорость теплового движения молекул.
Принимая во внимание, что n=N/V, м -3, R=Nаk, для 1 моля идеального газа:
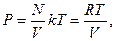
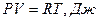
Уравнению рV =RT (1.10) удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, называемым также уравнением Клайперона - Менделеева.
Числовое значение молярной газовой постоянной определим из формулы (1.10), полагая, что моль газа находится при нормальных условиях(р0 = 1,013- 105 Па, T0= 273,15 К, Vm = 22,41 –10-3 м3/моль): R = 8,31 Дж/(мольК).
От уравнения (1.10) для моля газа можно перейти к уравнению Клапейрона - Менделеева для произвольной массы газа. Если при некоторых заданных давлении и температуре один моль газа занимает молярный объем Vm, то при тех же условиях масса т газа займет объем V = (т/М)Vm, где М - молярная масса (масса одного моля вещества). Единица молярной массы - килограмм на моль (кг/моль). Уравнение Клайперона - Менделеева для массы m газа
pV=m/M RT = vRT (1.11)
где v = m/М - количество вещества;
p, V, Т- термодинамические параметры данного состояния;
R - универсальная газовая постоянная;
М - молярная масса газа.
Уравнению рV =RT (1.10) удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, называемым также уравнением Клайперона - Менделеева.
Числовое значение молярной газовой постоянной определим из формулы (1.10), полагая, что моль газа находится при нормальных условиях(р0 = 1,013- 105 Па, T0= 273,15 К, Vm = 22,41 –10-3 м3/моль): R = 8,31 Дж/(мольК).
От уравнения (1.10) для моля газа можно перейти к уравнению Клайперона - Менделеева для произвольной массы газа. Если при некоторых заданных давлении и температуре один моль газа занимает молярный объем Vm, то при тех же условиях масса т газа займет объем V = (т/М)Vm, где М - молярная масса (масса одного моля вещества). Единица молярной массы - килограмм на моль (кг/моль). Уравнение Клайперона - Менделеева для массы m газа
pV=m/M RT = vRT (1.11)
где v = m/М - количество вещества;
p, V, Т- термодинамические параметры данного состояния;
R - универсальная газовая постоянная;
М - молярная масса газа.
Рассмотрим законы, описывающие поведение идеальных газов.
Закон Бойля - Мариотта [Р. Бойль (1627-1691) – английский ученый; Э.Мариотт (1620-1684) - французский физик]: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
рV = соnst при T = соnst:, т = const. (1.2)
Кривая, изображающая зависимость между величинами р и V, характеризующими свойства вещества при постоянной температуре, называется изотермой. Изотермы представляют собой гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс (рис. 1).
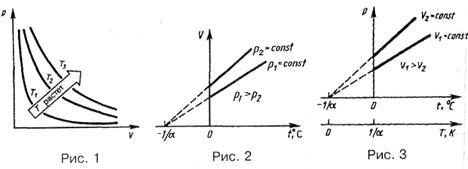 |
Закон Шарля [(Ж. Шарль (1746-1823) - французский ученый]: давление данной массы газа при постоянном объеме изменяется линейно с температурой:
р = р0 (1 + αt) при V = const, m = соnst. (1.3)
Процесс, протекающий при постоянном давлении, называется изобарным. На диаграмме в координатах V, t (рис. 2) этот процесс изображается прямой, называемой изобарой.
Закон Гей-Люссака [Ж. Гей-Люссак (1778-1850.) - французский ученый]: объем данной массы газа при постоянном давлении изменяется линейно с температурой:
V = V0 (1 + αt) при V = const, m = соnst. (1.4)
Процесс, протекающий при постоянном объеме, называется изохорным. На диаграмме в координатах p, t (рис. 3) он изображается прямой, называемой изохорой.
В уравнениях (1.3) и (1.4) t - температура по шкале Цельсия, р0 и V0 - давление и объем при 0°С, коэффициент α = 1/273,15 К-1.
Если в формулы (1.3) и (1.4) подставить данный коэффициент, то они соответственно примут вид
р = р0(1 + t/273, 1 5) = p0 [(273, 1 5 +t)/0/273, 15];
V = V0 (1 + t/273,15) = V0[(273,15 + t)/273,15].
Учитывая формулу (1.1), можно перейти к термодинамической температуре
P=TP0/273,15= α p0T; V=TV0/273,15= α V0T
или
V/Т = соnst при р - const, т = сonst; (1.5)
р/Т= соnst при V= соnst, т = сonst (1.6)
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях этот объем равен 22,41 • 10-3 м3/моль.
Закон Дальтона [Дж. Дальтон (1766 - 1844) - английский химик и физик]: давление смеси идеальных газов равно сумме парциальных давлений р., ря р2,..., рn входящих в нее газов:
p=р1+р2+…+pn
Парциальное давление - давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
13. Взаимосвязь теплоты и работы. Первое начало термодинамики. Работа, совершаемая телом при изменении объема. Работа газа в различных изопроцессах.
Термодинамика — это наука о закономерностях превращения одних видов энергии в другие. Значение термодинамики состоит в том, что она устанавливает принципы наиболее эффективного и оптимального преобразования энергии. Этим термодинамика дает ответ на вопрос, как нужно организовать рабочий процесс в тепловом двигателе, чтобы КПД его был максимальным.
Термодинамической системой называют совокупность макроскопических тел, находящихся в энергетическом (механическом и тепловом) взаимодействии друг с другом и другими телами, окружающими их, а также обменивающихся друг с другом веществом.
В термодинамике производится сопоставление рассматриваемой системы с окружающей средой, изучаются взаимодействия как внутри системы, так и между системой и окружающей средой. Если между системой и окружающей средой возможны все три типа взаимодействия, система называется открытой. В закрытой системе обмен веществом с другими системами отсутствует. Адиабатной называют систему, в которой отсутствует теплообмен с другими системами. Адиабатными могут быть как открытая, так и закрытая системы. Система, не взаимодействующая с окружающей средой или другими системами ни энергетически, ни веществом, называется изолированной.
Различают термодинамические системы: однородные (однофазные), или гомогенные, и неоднородные (многофазные), или гетерогенные. Гомогенные системы имеют одинаковые или непрерывно и равномерно изменяющиеся химический состав и физические свойства. Например, газ, находящийся в баллоне; атмосферный воздух, давление которого изменяется непрерывно jio высоте; чистые, без сажи, продукты сгорания.
Гетерогенная система состоит из двух или более гомогенных областей, называемых фазами. На границах фаз скачкообразно изменяются химический состав или физические свойства вещества. Например, гетерогенная система из воды и льда имеет одинаковый химический состав, но разные физические свойства, а гетерогенная система из воды и куска сливочного масла — и разный состав, и разные свойства.
Совокупность физических свойств термодинамической системы в рассматриваемых условиях называют состоянием системы. Величины, характеризующие состояние термодинамической системы, называют термодинамическими параметрами: давление — Р, удельный объем — V, температура— Т, внутренняя энергия — U, энтальпия — h, энтропия — s и др. Параметры, не зависящие от размеров системы (ее протяженности, массы), например температуру, давление, называют интенсивными, зависящие же, например объем, энтальпию, энтропию, — экстенсивными или аддитивными.
Если параметры с течением времени не изменяются, то состояние системы называется стационарным.
Состояние, в которое приходит система при постоянных внешних условиях, характеризуемое неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и теплоты, называют равновесным.
Процесс передачи энергии направленного движения микрочастиц от рассматриваемого тела к другим телам и наоборот представляет собой работу А, Дж. Процесс отдачи или восприятия энергии хаотического молекулярного и внутримолекулярного движения называется теплотой, а количество переданной энергии — количеством теплоты Q, Дж. Другие формы передачи энергии неизвестны. Таким образом, принимается, что теплота и работа являются двумя единственно возможными формами передачи энергии.
Для конечного состояния изменения системы первое начало термодинамики: Q=∆U+А,
где: Q - количество теплоты, подводимое к системе; ∆U – изменение внутренней энергии газа; А – работа, совершаемая газом против внешних сил в изопроцессах.
Следует напомнить еще одну из формулировок первого закона — вечный двигатель первого рода невозможен. Вечный двигатель первого рода — это такой воображаемый механизм, который при наличии первоначального энергетического импульса способен безостановочно двигать сам себя и, кроме того, производить полезную работу.
Работа, совершаемая газом против внешних сил в изопроцессах:
а) изохорном (V=const)
А=0;
б) изобарном (р=const)
A =p×DV= mR/Mp×(T2-T1)
в) изотермическом (Т==const)
Найдем работу изотермического расширения газа
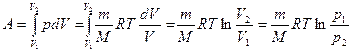
г) адиабатическом (Q=0)
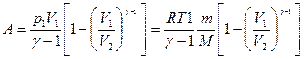
14. Теплоемкость тела, удельная, молярная, теплоемкости Cp и Cv. Второе начало термодинамики.
Одним из основных свойств тел, имеющих большое значение в термодинамическом методе исследования, является теплоемкость.
Теплоемкость - физическая характеристика вещества, которая показывает, какое количество энергии необходимо подвести к телу, чтобы повысить его температуру на один градус; численно равна отношению теплоты δQ, сообщаемой телу, к изменению dT температуры тела в рассматриваемом термодинамическом процессе:
C* = δQ/dT. (3.6)
Теплоемкость тела зависит от его химического состава, массы тела и его термодинамического состояния, а также, как видно из определения С*, от вида процесса изменения состояния тела, в которое поступает теплота δQ.
Удельная теплоемкость вещества - величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
c = δQ/mdT.
Единица удельной теплоемкости - джоуль на килограмм - кельвин (Дж/(кг * К)).
Молярная теплоемкость - величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
Cm = δQ/vdT,
где v =m/М - количество вещества.
Единица молярной теплоемкости - джоуль на моль-кельвин (Дж/(моль * К)). Удельная теплоемкость связана с молярной Сm соотношением
Сm = сМ, (3.7)
где М - молярная масса вещества.
Различают теплоемкости при постоянном объеме и постоянном давлении в зависимости от того, какой параметр в процессе нагревания вещества поддерживается постоянным.
Ср = Сv + R. (3.11)
Выражение (3.11) называется уравнением Майера [Ю.Р. Майер (1814-1878) - немецкий естествоиспытатель]; оно показывает, что Ср всегда больше Сv на величину молярной газовой. постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа. Использовав выражение (3.10), выражение (3.11) можно записать в виде
Ср = i+2/2*R. (3.12)
При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение Ср к Сv:
γ = Cp/Cv = (i+2)/i. (3.13)
Первое начало термодинамики, выражая закон сохранения и превращения энергии, не позволяет установить направление протекания термодинамических процессов. Кроме того, можно представить множество процессов, не противоречащих первому началу, в которых энергия сохраняется, а в природе они не осуществляются. Появление второго начала термодинамики связано с необходимостью, дать ответ на вопрос, какие процессы в природе возможны, а какие – нет. Второе начало термодинамики определяет направление протекания термодинамических процессов.
Понятие энтропии введено в 1865 г. Р. Клаузиусом. Для выяснения физического содержания этого понятия рассматривают отношение теплоты Q, полученной телом в изотермическом процессе, к температуре T теплоотдающего тела, называемое приведенным количеством теплоты.
Приведенное количество теплоты, сообщаемое телу на бесконечно малом участке процесса, равно dQ/T. Анализ показывает, что приведенное количество теплоты, сообщаемое телу в любом обратимом круговом процессе, равно нулю:
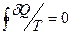 .
.
Используя понятие энтропии и неравенство Клаузиуса (DS ³ 0), второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Можно дать более краткую формулировку второго начала термодинамики: в процессах, происходящих в замкнутой системе, энтропия не убывает.
Здесь существенно то, что речь идет о замкнутых системах, так как в незамкнутых системах энтропия, может вести себя любым образом (убывать, возрастать, оставаться постоянной). Кроме того, отметим еще раз, что энтропия остается постоянной в замкнутой системе только при обратимых процессах. При необратимых процессах в замкнутой системе энтропия всегда возрастает.
Приведем еще две формулировки второго начала термодинамики:
1) невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу;
2) невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
 2015-05-13
2015-05-13 3373
3373
