Все жидкости по растворимости друг в друге можно разделить на три типа:
1) Неограниченно растворимые.
2) Ограниченно растворимые.
3) Практически нерастворимые.
Рассмотрим системы, составленные из двух ограниченно растворимых жидкостей. Практическое значение имеет главным образом зависимость взаимной растворимости от температуры при постоянном давлении. Для характеристики этих систем на основании экспериментальных данных строят диаграммы растворимости.
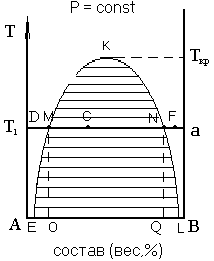
Рисунок 8 – Диаграмма ограниченной взаимной растворимости двух жидкостей с верхней критической температурой растворимости
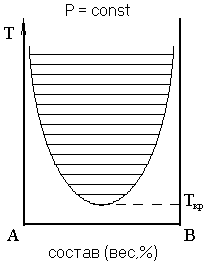
Рисунок 9 – Диаграмма ограниченной взаимной растворимости двух жидкостей с нижней критической температурой растворимости
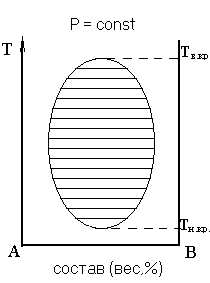
Рисунок 10 – Диаграмма ограниченной взаимной растворимости двух жидкостей с верхней и нижней критической температурами растворимости
На каждой из трёх диаграмм заштрихованные области являются гетерогенными, здесь имеется две фазы. Кривая, ограничивающая гетерогенную область, называется кривой расслоения (бинодальная кривая). Область, расположенная за пределами кривой расслоения, является гомогенной. Критическая температура – это температура, выше которой на диаграммах с верхней критической температурой и ниже которой на диаграммах с нижней критической температурой, жидкости неограниченно растворимы друг в друге.
Проанализируем диаграмму с верхней критической температурой растворимости (рисунок 8). Левая ветвь кривой ЕМК показывает зависимость растворимости вещества В в А; правая ветвь кривой KNL показывает зависимость растворимости А в В. Проанализируем, как будет изменяться состав фаз и число степеней свободы при постоянной температуре при увеличении содержания жидкости В в системе. Общая масса системы должна быть неизменной.
В точке D имеем ненасыщенный раствор В в А, система гомогенна. Число степеней свободы по правилу фаз Гиббса равно: f= 2 – 1 + 1 = 2.Дальнейшее увеличение содержания В вызывает смещение точки D вдоль линии DF. При этом точке М будет соответствовать насыщенный раствор состава О. Значит, любой точке на линии ЕМК соответствует насыщенный раствор В в А, а любой точке на кривой KNL- насыщенный раствор А в В.
Любой точке под кривой EMKNL (например, точке С) соответствует гетерогенная (двухфазная) система. Чтобы найти состав фаз, находящихся в равновесии, через точку С проводят ноду (конноду). Линия (MN), соединяющая точки сопряженных (равновесных между собой) фаз, называется нодой (коннодой). Точка С называется фигуративной и отражает состав двухкомпонентной системы. Массу соравновесных фаз, на которые распадается гетерогенная система в точке С, можно рассчитать по правилу рычага:
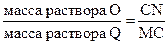
Вопрос о взаимной растворимости двух жидкостей представляет большой теоретический и практический интерес. В отношении взаимной растворимости жидкостей часто применяется эмпирическое правило: подобное растворяется в подобном, т.е. полярные вещества растворяются в полярных растворителях; неполярные вещества – в неполярных растворителях.
 2015-07-04
2015-07-04 7617
7617








