Существует три типа диаграмм равновесия жидкость-пар реальных растворов.
Бинарные растворы с положительными отклонениями от закона Рауля без азеотропной смеси подчиняются первому закону Коновалова: пар, находящийся в равновесии с кипящей жидкостью, богаче тем компонентом, прибавление которого к жидкости повышает давление пара над ней, понижает температуру кипения, т.е. пар, находящийся в равновесии с кипящей жидкостью, обогащается более летучим (низкокипящим) компонентом.
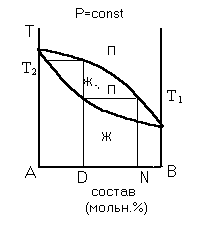
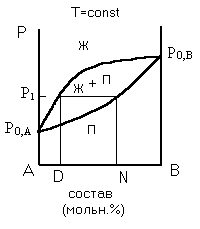
| Рисунок 2 – Фазовая диаграмма давление-состав для реального двухкомпонентного раствора с положительным отклонением от закона Рауля без азеотропа | Рисунок 3 – Фазовая диаграмма температура-состав для реального двухкомпонентного раствора с положительным отклонением от закона Рауля без азеотропа |
Диаграммы (рис. 2 и 3) иллюстрируют справедливость первого закона Коновалова. Приготовим раствор состава “D” и проведем перегонку. При давлении Р1 раствор закипит и появится первый пузырек пара состава “N”, т. е. пар обогатился более летучим компонентом В по сравнению с исходной жидкостью состава D. На диаграмме зависимости температура-состав раствора (рис. 3) температура начала кипения раствора состава D равна Т1; состав первого пузырька пара соответствует точке N.
Повышение относительного содержания данного компонента в жидкой фазе всегда вызывает увеличение относительного содержания его в паре.
Реальные растворы с положительным отклонением от закона Рауля без азеотропа можно разделить дистилляцией (фракционной перегонкой) в лаборатории и ректификацией в промышленности на чистые компоненты.
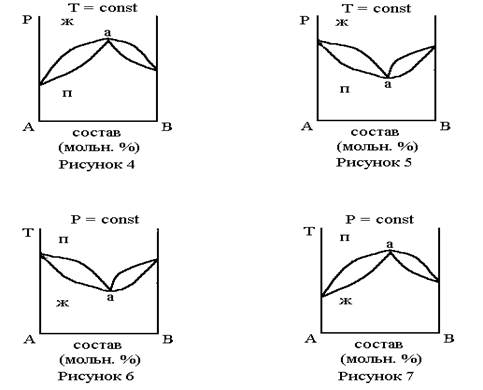 |
Реальные растворы с азеотропной точкой подчиняются второму закону Коновалова: точки максимума и минимума (точки экстремума) на кривой общего давления пара отвечают растворам, состав которых одинаков с составом равновесного с ним пара. Справедливость данного закона можно проиллюстрировать с помощью фазовых диаграмм равновесия жидкость-пар для реальных растворов в координатах давление-состав с азеотропом (рисунки 4,5) и фазовых диаграмм равновесия жидкость-пар для реальных растворов в координатах температура-состав с азеотропом (рисунки 6,7).
Точки “a” на диаграммах называются азеотропными, а смеси, соответствующие этим точкам, называются азеотропными смесями (нераздельно кипящими). В азеотропных точках состав пара одинаков с составом равновесной с ним жидкости. Число степеней свободы в азеотропной точке равно нулю (f = 1-1+2=0). Азеотропную смесь невозможно разделить методом фракционной перегонки на чистые компоненты А и В.
 2015-07-04
2015-07-04 8864
8864
