При растворении вещества одновременно проходят два процесса:
1. Дробление вещества до молекул или ионов. Этот процесс требует затраты энергии, поэтому сопровождается поглощением тепла, расходуемого на разрушение кристаллической решетки растворяемого вещества или диссоциацию его молекул на ионы. Поэтому 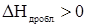 , процесс эндотермический.
, процесс эндотермический.
2. Взаимодействие растворенных молекул или ионов с молекулами растворителя – сольватация (гидратация, если растворитель - вода). Этот процесс сопровождается выделением тепла (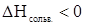 ) и называется экзотермическим.
) и называется экзотермическим.
В целом теплота растворения 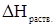 складывается
складывается
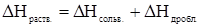
и может быть как отрицательной, так и положительной, в зависимости от преобладания составляющих процессов.
Растворимость (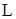 ), определяемая как концентрация насыщенного раствора (
), определяемая как концентрация насыщенного раствора (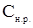 ), равняется константе равновесия процесса образования насыщенного раствора при данной температуре
), равняется константе равновесия процесса образования насыщенного раствора при данной температуре
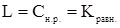 . (2.15)
. (2.15)
Поскольку растворение – это равновесный процесс, то зависимость растворимости от температуры при постоянном давлении подчиняется уравнению изобары
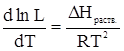 .
.
Если образование раствора сопровождается выделением тепла (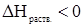 ), то растворимость вещества с повышением температуры будет уменьшаться. Если же растворение эндотермическое, т.е. идет с поглощением тепла, то при увеличении температуры растворимость возрастает.
), то растворимость вещества с повышением температуры будет уменьшаться. Если же растворение эндотермическое, т.е. идет с поглощением тепла, то при увеличении температуры растворимость возрастает.
Идеальными растворами считаются растворы, соответствующие двум требованиям:
1. Размеры молекул всех компонентов раствора нулевые.
2. Силы взаимодействия между всеми компонентами раствора отсутствуют.
Из реальных растворов таким требованиям соответствуют только разбавленные и совершенные растворы.
Разбавленными называют растворы, в которых концентрация растворенного вещества приближается к нулю.
Совершенными называются растворы, образованные веществами с очень близкими физико–химическими свойствами.
Закон Рауля. Основным законом идеальных растворов является закон Рауля.
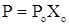 ,
,
где 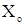 - мольная доля растворителя в растворе;
- мольная доля растворителя в растворе; 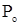 - давление насыщенного пара растворителя над чистым растворителем,
- давление насыщенного пара растворителя над чистым растворителем, 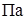 ;
; 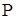 - давление насыщенного пара растворителя над раствором,
- давление насыщенного пара растворителя над раствором, 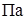 .
.
В случае бинарного раствора
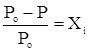 ,
,
где 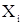 - мольная доля растворенного вещества в растворе.
- мольная доля растворенного вещества в растворе.
Чрезвычайно важными являются следствия из закона Рауля.
1. Температура кипения раствора всегда выше температуры кипения чистого растворителя при одинаковом внешнем давлении.
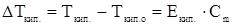 ,
,
где 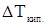 - повышение температуры кипения раствора относительно чистого растворителя,
- повышение температуры кипения раствора относительно чистого растворителя, 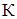 ;
; 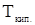 и
и 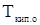 -соответственно температура кипения раствора и чистого растворителя,
-соответственно температура кипения раствора и чистого растворителя, 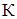 ;
; 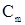 - моляльная концентрация растворенного вещества,
- моляльная концентрация растворенного вещества, 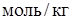 ;
; 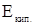 - эбулиоскопическая постоянная растворителя,
- эбулиоскопическая постоянная растворителя, 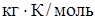 .
.
Эбулиоскопическая постоянная показывает, на сколько градусов повышается температура кипения раствора на каждый моль растворенного вещества. Она не зависит от природы и концентрации растворенного вещества, а зависит только от природы растворителя.
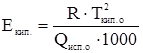 ,
,
где 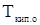 - температура кипения растворителя, К;
- температура кипения растворителя, К; 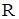 - универсальная газовая постоянная, 8,314 Дж/моль∙К;
- универсальная газовая постоянная, 8,314 Дж/моль∙К; 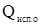 - удельная теплота испарения растворителя, Дж/г, 1000 – коэффициент перехода от г в кг.
- удельная теплота испарения растворителя, Дж/г, 1000 – коэффициент перехода от г в кг.
2. Температура замерзания раствора всегда ниже температуры замерзания растворителя при одинаковом внешнем давлении.
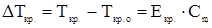 ,
,
где 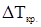 - снижение температуры кристаллизации раствора относительно чистого растворителя, К;
- снижение температуры кристаллизации раствора относительно чистого растворителя, К; 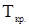 и
и 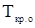 -соответственно температура кристаллизации раствора и чистого растворителя, К;
-соответственно температура кристаллизации раствора и чистого растворителя, К; 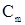 - моляльная концентрация растворенного вещества, моль/кг;
- моляльная концентрация растворенного вещества, моль/кг; 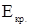 - криоскопическая постоянная растворителя, кг∙К/моль.
- криоскопическая постоянная растворителя, кг∙К/моль.
Криоскопическая постоянная не зависит от природы и концентрации растворенного вещества, а определяется только свойствами растворителя и может быть рассчитана
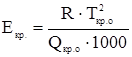 ,
,
где 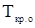 - температура кристаллизации растворителя, К;
- температура кристаллизации растворителя, К; 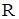 - универсальная газовая постоянная, 8,314 Дж/моль∙К;
- универсальная газовая постоянная, 8,314 Дж/моль∙К; 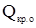 - удельная теплота кристаллизации растворителя, Дж/г; 1000 – коэффициент перехода от г в кг.
- удельная теплота кристаллизации растворителя, Дж/г; 1000 – коэффициент перехода от г в кг.
Если растворенное вещество является электролитом, то в указанные законы необходимо ввести изотонический коэффициент (i).
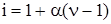 ,
,
где 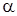 - степень диссоциации растворенного вещества в растворе;
- степень диссоциации растворенного вещества в растворе; 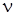 -число ионов, образующихся при диссоциации молекулы растворенного вещества.
-число ионов, образующихся при диссоциации молекулы растворенного вещества.
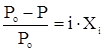 ;
; 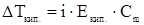 ;
; 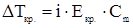 .
.
Второе следствие из закона Рауля находит применение для экспериментального определения молярной массы растворенного вещества неэлектролита.
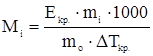 ,
,
где 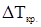 - понижение температуры кристаллизации раствора по отношению к чистому растворителю, К;
- понижение температуры кристаллизации раствора по отношению к чистому растворителю, К; 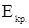 - криоскопическая постоянная растворителя, К∙кг/моль;
- криоскопическая постоянная растворителя, К∙кг/моль; 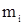 - масса растворенного вещества, г,
- масса растворенного вещества, г, 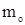 - масса растворителя, кг;
- масса растворителя, кг; 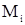 - молярная масса растворенного вещества, г/моль.
- молярная масса растворенного вещества, г/моль.
Закон Генри. Растворимость газов в жидких растворителях (не сталях) описывается законом Генри: при постоянной температуре растворимость газа в данном растворителе прямо пропорциональна парциальному давлению данного газа над растворителем.
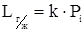 ,
,
где 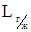 - растворимость i –го газа в жидкости, кг/м3;
- растворимость i –го газа в жидкости, кг/м3; 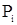 - парциальное давление i –го газа над жидкостью, Па;
- парциальное давление i –го газа над жидкостью, Па; 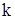 - коэффициент Генри, кг/м3∙Па.
- коэффициент Генри, кг/м3∙Па.
Коэффициент Генри (константа Генри) зависит от природы газа и жидкости, а также от температуры. Так как при растворении газа в жидкости отсутствует процесс дробления вещества, то растворение является экзотермическим процессом взаимодействия газа с жидкостью. Поскольку 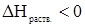 , то растворимость газов в жидкостях при повышении температуры уменьшается (см. уравнение изобары).
, то растворимость газов в жидкостях при повышении температуры уменьшается (см. уравнение изобары).
Закон Сивертса. В случае растворимости двухатомных газов в жидких металлах (расплавах) имеет место процесс дробления (атомизации) молекул газов. Поэтому для таких растворов 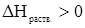 и растворимость двухатомных газов в расплавах металлов при увеличении температуры увеличивается. Влияние давления на растворимость газа в расплавах металла описывается законом Сивертса: при постоянной температуре растворимость двухатомных газов в расплавленных металлах прямо пропорциональна квадратному корню из парциального давления данного газа над растворителем.
и растворимость двухатомных газов в расплавах металлов при увеличении температуры увеличивается. Влияние давления на растворимость газа в расплавах металла описывается законом Сивертса: при постоянной температуре растворимость двухатомных газов в расплавленных металлах прямо пропорциональна квадратному корню из парциального давления данного газа над растворителем.
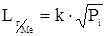 ,
,
где 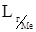 - растворимость i –го газа в расплаве металла, кг/м3;
- растворимость i –го газа в расплаве металла, кг/м3; 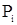 - парциальное давление i –го газа над расплавом, Па;
- парциальное давление i –го газа над расплавом, Па; 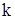 - коэффициент Сивертса, кг/м3∙Па1/2.
- коэффициент Сивертса, кг/м3∙Па1/2.
Закон распределения Нернста – Шилова. Если в системе, состоящей из двух несмешивающихся жидкостей, находится третье вещество, то оно распределяется между этими жидкостями, согласно закона распределения: отношение концентраций третьего компонента в двух несмешивающихся жидкостях есть величина постоянная, не зависящая от относительных количеств жидкостей и от количества третьего вещества. Она определяется природой растворителей, растворенного вещества и температурой.
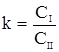 ,
,
где 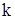 -константа распределения;
-константа распределения; 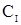 и
и 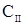 - концентрация компонента в первой и второй несмешивающихся жидкостях соответственно.
- концентрация компонента в первой и второй несмешивающихся жидкостях соответственно.
Этот закон находит широкое применение в процессах очистки экстракцией сталей, сплавов и в получении сверхчистых веществ.
 ,
,
где 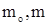 - соответственно начальное и конечное после
- соответственно начальное и конечное после 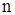 - кратных экстракций содержание третьего вещества в первой жидкости;
- кратных экстракций содержание третьего вещества в первой жидкости; 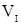 - объём жидкости, из которой производится извлечение третьего компонента;
- объём жидкости, из которой производится извлечение третьего компонента; 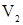 - объём жидкости, которой проводят извлечение третьего компонента из первой жидкости;
- объём жидкости, которой проводят извлечение третьего компонента из первой жидкости; 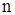 - кратность обработки жидкости объёма
- кратность обработки жидкости объёма 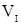 жидкостью объёмом
жидкостью объёмом 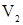 .
.
 2015-07-03
2015-07-03 7661
7661






