Сущность буферного действия смеси слабой кислоты с ее солью можно рассмотреть на примере ацетатного буферного раствора.
При добавлении к нему сильной кислоты (например, HCl) происходит реакция:
| CH3COONa + HCl = NaCl + CH3COOH | – молекулярное уравнение |
| CH3COO– + Na+ + H+ + Cl– = Na+ + Cl– + CH3COOH | – полное ионное уравнение |
| H+ + CH3COO– = CH3COOH | – сокращенное ионное уравнение |
В результате этого воздействия сильная кислота замещается на эквивалентное количество плохо диссоциированной слабой кислоты буферной системы, поэтому концентрация ионов Н+ (активная кислотность) в растворе существенно не изменяется.
Пока солевая компонента буферной системы не расходуется в данной реакции, раствор в той или иной степени будет сохранять свое буферное действие.
При добавлении к буферной смеси сильного основания (например, NaOH) происходит реакция:
| CH3COOH + NaOH = CH3COONa + H2O | – молекулярное уравнение |
| CH3COOH + Na+ + OH– = CH3COO– + Na+ + H2O | – полное ионное уравнение |
| CH3COOН + OH– = CH3COO– + H2O | – сокращенное ионное уравнение |
В результате сильное основание замещается на эквивалентное количество нейтральной соли буферной системы, поэтому концентрация ионов водорода в ней опять изменится незначительно.
Буферное действие раствора при этом будет наблюдаться, пока полностью не расходуется слабая кислота.
Если к буферному раствору попеременно добавлять в небольших количествах сильную кислоту или щелочь, то его буферное действие сможет сохраняться более длительное время, т.к. в результате протекающих реакций буферная система будет периодически восстанавливать свой первоначальный количественный и качественный состав.
Для кислотной буферной системы, образованной двумя солями, механизм действия будет аналогичным. Рассмотрим его на примере фосфатного буфера: NaH2PO4 + Na2HPO4.
Добавленная к нему сильная кислота провзаимодействует с солевой компонентой системы и заместится на эквивалентное количество компоненты, играющей роль слабой кислоты.
| Na2HPO4 + HCl = NaH2PO4 + NaCl | – молекулярное уравнение |
| 2Na+ + HPO42– + H+ + Cl– = 2Na+ + H2PO4– + Cl– | – полное ионное уравнение |
| HPO42– + H+ = H2PO4– | – сокращенное ионное уравнение |
Внесенная щелочь, наоборот, заместится на эквивалентное количество нейтральной солевой компоненты буфера:
| NaH2PO4 + NaOH = Na2HPO4 + H2O | – молекулярное уравнение |
| Na+ + H2PO4– + Na+ + OH– = 2Na+ + HPO42– + H2O | – полное ионное уравнение |
| H2PO4– + OH– = HPO42– + H2O | – сокращенное ионное уравнение |
Механизм действия основных буферных систем рассмотрим на примере аммиачного буфера.
Добавленная к нему сильная кислота провзаимодействует со слабым основанием и заместится на эквивалентное количество солевой компоненты буфера:
| NH3 × H2О + HCl = NH4Cl + H2О | – молекулярное уравнение |
| NH3 × H2О + H+ + Cl– = NH4+ + Cl– + H2О | – полное ионное уравнение |
| NH3 × H2О + H+ = NH4++ H2О | – сокращенное ионное уравнение |
Щелочь вступит в реакцию с солью буферной системы и вместо нее образуется эквивалентное количество слабого основания:
| NH4Cl + NaOH = NH3 × H2О + NaCl | – молекулярное уравнение |
| NH4+ + Cl– + Na+ + OH– = NH3 × H2О + Na+ + Cl– | – полное ионное уравнение |
| NH4+ + OH– = NH3 × H2О | – сокращенное ионное уравнение |
Таким образом, рассмотренные примеры показывают, что буферное действие растворов независимо от их состава обусловлено взаимодействием внесенных в них ионов Н+ или ОН– с соответствующим компонентом буфера. В результате этого происходит их связывание в растворе за счет образования слабодиссоциированного продукта реакции, т.е. (говоря другими словами) перевод в потенциальную кислотность либо основность. Вследствие этого активная кислотность (основность) самой буферной системы существенно не изменяется и остается на первоначальном уровне.
Вычисление рН и рОН буферных систем. Уравнение Гендерсона-Гассельбаха
Каждая из буферных систем характеризуется определенной присущей ей концентрацией ионов Н+ (активной кислотностью), которую система и стремится сохранить на неизменном уровне при добавлении к ней сильной кислоты либо щелочи.
Установим на примере ацетатного буфера факторы, влияющие на величину активной кислотности.
В растворе данной буферной системы происходят следующие процессы электролитической диссоциации:
CH3COOH 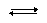 CH3COO– + H+
CH3COO– + H+
CH3COONa → CH3COO– + Na+
(Гидролиз соли, т.е. взаимодействие ацетат-ионов с Н2О CH3COO– + HOH  CH3COOH + OH– учитывать не будем.)
CH3COOH + OH– учитывать не будем.)
Таким образом, ионы Н+ образуются только за счет диссоциации некоторого числа молекул уксусной кислоты. Этот процесс является обратимым и количественно характеризуется константой кислотности Kа:
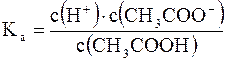
где с (H+) (или c (H3O+)), c(СН3СОО–) и c (СН3СООH) равновесные молярные концентрации ионов Н+, СН3СОО– и непродиссоциированных молекул кислоты.
Из данного уравнения можно выразить  (активную кислотность буферной системы):
(активную кислотность буферной системы):
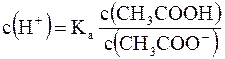
Кроме уксусной кислоты, в растворе присутствует ее соль CH3COONa. Она является сильным электролитом и полностью распадается на ионы. В результате этого концентрация анионов СН3СОО– резко возрастает, и согласно принципу Ле-Шателье, равновесие реакции диссоциации уксусной кислоты смещается влево, т.е. в сторону образования ее молекул. Причем диссоциация уксусной кислоты в присутствии собственной соли может быть настолько подавленной, что равновесную концентрацию ее нераспавшихся молекул в растворе можно считать равной концентрации СН3СООН, а равновесную концентрацию ацетат-ионов – исходной концентрации соли. В связи с этим выражение, по которому рассчитывается концентрация ионов Н+, можно записать иначе:
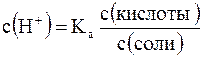
где с (кислоты) и с (соли) – исходные концентрации компонентов буферной системы.
Прологорифмируем полученное уравнение (с учетом того, что логарифм произведения равен сумме логарифмов сомножителей):
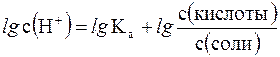
и умножим обе его части на –1:

Как было показано нами ранее
 , a
, a 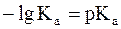
В связи с этим запишем уравнение для расчета концентрации ионов Н+ в окончательном виде:
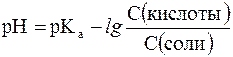
Данное выражение называется иначе уравнением Гендерсона-Гассельбаха. Его можно использовать для вычисления рН любой кислотной буферной системы. Например, для фосфатного буфера уравнение Гендерсона-Гассельбаха запишется следующим образом:
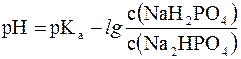
(в данной системе роль слабой кислоты играет анион Н2РО4–, то 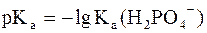 .
.
В водных растворах рН и рОН являются сопряженными величинами. Их сумма всегда равна 14, т.е.:
рН + рОН = 14
Зная концентрацию ионов Н+ или рН, можно вычислить концентрацию гидроксильных ионов или рОН.
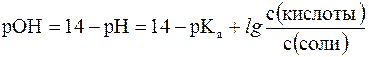
Уравнения Гендерсона-Гассельбаха для расчета рОН и рН в оснóвных буферных системах выглядят следующим образом:


где pKb = –lg Kb (основания), с(основания) и с (соли) – исходные молярные концентрации компонентов данных буферных систем, т.е. слабого основания и его соли с сильной кислотой.
 2014-02-02
2014-02-02 21960
21960
