При добавлении к ацетатной буферной смеси сильного основания пойдет реакция нейтрализации уксусной кислоты:
CH3COOH + NaOH® CH3COONa + H2O
H+ + OH-® H2O
В фосфатной буферной смеси роль слабой кислоты, нейтрализующей избыток гидрооксид ионов, играет дигидрофосфат-ион:
NaH2PO4 + NaOH®Na2HPO4 + H2O
H2PO4- + OH-®HPO42- + H2O
В качестве буферных смесей применяют смеси:
СН3СООН и СН3СООNa (ее соли) ацетатная буферная смесь.
NH4OH и NH4Cl аммонийная буферная смесь.
Фосфатная буферная смесь: одно- или двузамещенные соли фосфорной кислоты:
NaH2PO4,Na2HPO4
Кислота соль.
Почему введение буферной смеси поддерживает рН в растворе?
1. СН3СООН «СН3СОО- + Н+ Ка = 1,75∙10-5
2. СН3СООNa«СН3СОО- + Na+диссоциирует нацело.
При добавлении HCl:HCl«H+ + Cl-
в соответствии с принципом Ле-Шателье (1) реакция идет в обратную сторону.
При добавлении соляной кислоты, которая нацело диссоциирует на катионы водорода и хлорид-ионы, концентрация Н+ возрастает. Поэтому в соответствии с принципом Ле-Шателье равновесие смещается в сторону недиссоциированных молекул уксусной кислоты. Поэтому рН раствора будет неизменным. Изменение концентрации [H+] будет значительно слабее изменения концентрации кислоты 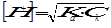 .
.
Введем в смесь NaOH. NaOH«Na+ + OH-.
В случае введения щелочи концентрация кислоты несколько уменьшается из-за Н++ОН-, которые выводятся из сферы реакции. А изменение рН не происходит.
Для характеристики эффективности буферных растворов введено понятие буферной емкости, обозначается p. p – это количество моль-эквивалентов сильной кислоты или сильной щелочи, которое нужно ввести в 1 литр буферного раствора, чтобы изменить водородный показатель на единицу.
СН3СООН + NaOH«СН3СООNa + Н2О
a = 1.
Рассмотрим ацетатный буфер.
p = 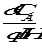 изменение концентрации аниона
изменение концентрации аниона
p = - 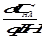 изменение концентрации кислоты, знак минус означает, она убывает.
изменение концентрации кислоты, знак минус означает, она убывает.
СН3СООNa + НCl«СН3СООН + NaCl
П = - 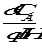 изменение концентрации аниона, знак минус означает, она убывает.
изменение концентрации аниона, знак минус означает, она убывает.
p = 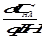 изменение концентрации кислоты.
изменение концентрации кислоты.
Всегда ценно найти раствор, в котором буферная емкость мкасимальна. Необходимо знать зависимость буферной емкости от концентрации компонентов буферной системы, константу диссоциации слабой кислоты или слабого основания, входящих в состав буферной смеси.
Для расчета буферной емкости (без вывода)
p = 2,3 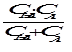 или p = 2,3
или p = 2,3 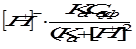
с учетом, что рН = -lg[H+]
Сбуф= СНА + СА-.
Далее приравниваем - 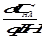 =0, т.е. находим максимум p по кислоте и находим рН, при котором pмаксимальна,т.е.
=0, т.е. находим максимум p по кислоте и находим рН, при котором pмаксимальна,т.е. 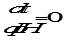
 2015-01-21
2015-01-21 1153
1153
