Объектом наших исследований являются физико-химические системы, между отдельными частями которых возможен обмен энергией и веществом. Мы будем рассматривать равновесные системы, состоящие из нескольких компонентов и включающие в себя несколько фаз, т.е. гетерогенные системы.
Фаза (Р) – это совокупность всех гомогенных частей системы, одинаковых во всех точках по составу и свойствам и ограниченных от других частей некоторой видимой поверхностью раздела.
Компоненты (С) – это индивидуальные химические вещества, наименьшее число которых необходимо и достаточно для образования всех фаз данной равновесной системы. Компонент может быть выделен из системы и существовать вне нее.
При рассмотрении конкретных физико-химических систем следует различать общее число химически индивидуальных веществ, входящих в систему, и наименьшее их число, необходимое для образования данной системы. Возможны такие случаи:
1)Физическая система 1 класса. Вещества, составляющие систему, не реагируют друг с другом, тогда число компонентов равно числу веществ.
2)Физическая система П класса. В системе протекают химические реакции, тогда число компонентов меньше числа составляющих систему веществ. При этом не важно, какие вещества считать компонентами, а важно их число.
Пример 1: Рассмотрим систему: H2 (г.)+ I2(г.) ↔ 2 HI(г.)
Концентрации веществ, составляющих систему, не могут быть выбраны произвольно; они связаны друг с другом законом действия масс:
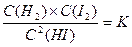 и стехиометрическим соотношением
и стехиометрическим соотношением 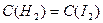 , поэтому число компонентов С = 1.
, поэтому число компонентов С = 1.
Пример 2: Как рассчитать число компонентов в водно – солевых системах?
Число компонентов в растворах солей равно количеству ионов, образующих данную систему, без учета воды. Так, в равновесной системе:
KCl +NH4NO3 ↔ KNO3+NH4Cl
К = 4(количество ионов) + 1(вода) – 1 уравнение
 2015-07-04
2015-07-04 323
323








