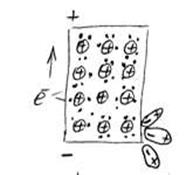
Рассмотрим элемент, состоящий из цинковой платины, опущенной в раствор электролита — сульфата цинка (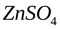 ).
).
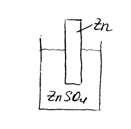
Сульфат цинка в водном растворе диссоциирует на ионе:
В свою очередь в растворе существуют молекулы воды, которые сильно поляризованы  Н2О
Н2О
Пластина цинка состоит из ионов 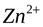 в узлах кристаллической решётки и электронов (поэтому металлы легко проводят электрический ток).
в узлах кристаллической решётки и электронов (поэтому металлы легко проводят электрический ток).
Ионы в металлах удерживаются за счёт энергии кристаллической решётки (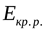 ). Ион в растворе удерживается за счёт сольватной (гидратной) оболочки, образуемой растворителем(
). Ион в растворе удерживается за счёт сольватной (гидратной) оболочки, образуемой растворителем(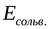 ).
).
1)< 
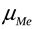 >
> 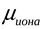
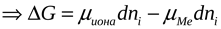 < 0
< 0
При погружении металла в раствор электролита ионы на поверхности кристаллической решётки металла взаимодействуют полярными молекулами растворителя (чаще воды), и образуется сольватная (гидратная) оболочка. Связь гидратированного иона с остальными ионами кристаллической решётки ослабевает, и он, если обладает достаточной кинетической энергией, переходит в раствор. При этом цинковая пластина заряжается отрицательно, т.к. остаются электроны. Таким образом, в раствор уходит много ионов. Но каждому последующему иону уйти труднее, чем предыдущей, т.к. растет отрицательный заряд на пластинке. И при каком-то отрицательном заряде на пластинке наступает состояние равновесия, когда число уходящих ионов в раствор будет равно числу ионов, приходящих из раствора.
|
|
|
При этом отрицательный заряд на пластинке меняться не будет. 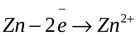
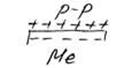
Сравнить величины отрицательного заряда при равновесии можно по таблице стандартных потенциалов.
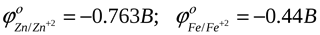
Еще раз отличу: если <, металл заряжается отрицательно.
2) Энергия кристаллизации решетки больше энергии сольватации >.
< 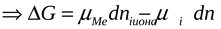 < 0
< 0
Ион растворенного вещества подходит к поверхности металла, восстанавливается и переходит в кристаллическую решетку металла. При этом металл заряжается положительно. К такому типу взаимодействия относятся восстановление меди из раствора.

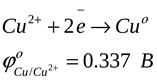
 2015-07-04
2015-07-04 1440
1440
