Растворы кипят при более высокой температуре чем чистый растворитель;
Следствия из закона Рауля
Растворы, которые строго подчиняются закону Рауля, являются идеальными. Для реальных растворов неэлектролитов закон Рауля соблюдается тем точнее, чем более разбавленным является этот раствор. По мере повышения концентрации растворенного вещества для большинства растворов наблюдаются отклонения от закона Рауля.
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Не подчиняются закону Рауля растворы электролитов (кислот, оснований, солей). Причем, даже в тех случаях, когда они являются разбавленными. Причина этого явления будет нами рассмотрена позже.
Из закона Рауля вытекают два важных следствия:
Рассмотрим их более подробно.
Кипение является физическим процессом перехода жидкости в газообразное состояние или пар, при котором пузырьки газа образуются по всему объему жидкости.
Жидкость закипает, когда давление ее насыщенного пара становится равным внешнему давлению. Если внешнее давление (например, атмосферное) не изменяется, а сама жидкость является индивидуальным и химически чистым веществом, то кипение ее в открытом подогреваемом сосуде происходит при постоянной температуре до тех пор, пока полностью не исчезнет жидкая фаза.
|
|
|
Так при атмосферном давлении равном 101,325 кПа температура кипения очищенной (дистиллированной) воды равна 100оС или 373,16 K.
Если же в Н2О растворить какое-нибудь нелетучее вещество, то давление ее насыщенного пара понизится. Чтобы получившийся раствор закипел, необходимо нагреть его до температуры выше, чем 373,16 K, т.к., только при таких условиях давление насыщенного пара растворителя снова станет равным атмосферному.
Замерзание или кристаллизация представляет собой физическое явление, сопровождающееся превращением жидкости в твердое вещество. Причем кристаллические структуры образуются во всем объеме жидкости.
Процесс замерзания начинается, если давление насыщенного пара над жидкостью становится равным давлению насыщенного пара над ее твердыми кристалликами.
Если внешнее (атмосферное) давление остается постоянным, а жидкость не содержит посторонних примесей, то в процессе кристаллизации температура охлаждаемой жидкости будет оставаться постоянной до тех пор, пока жидкая фаза полностью не превратится в твердую.
При атмосферном давлении равном 101,325 кПа дистиллированная вода замерзает при 0оС (273,16 K). Давление насыщенного пара воды надо льдом и жидкостью в этом случае равно 613,3 Па.
Для водного раствора давление насыщенного пара растворителя при 0оС будет меньше чем 613,3 Па, а надо льдом остается неизменным. Опущенный в такой раствор лед будет быстро таять, вследствие конденсации над ним избыточного количества пара.
|
|
|
Лишь при понижении температуры снова можно уравнять давление насыщенного пара над жидкой и твердой фазой и вызвать процесс кристаллизации.
Опытным путем было установлено, что повышение температуры кипения (Dtкип.) и понижение температуры замерзания раствора (Dtзам.) по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества. Математически это можно записать следующим образом:
tкип. р-ра – tкип. р-теля = Dtкип. = Em
tзам. р-теля – tзам. р-ра = Dtзам. = Km
где m – моляльная концентрация растворенного вещества; E и K – соответственно, эбуллиоскопическая (лат. ebbulio – выкипаю) и криоскопическая (греч. «криос» - холод) константы, значения которых зависят только от природы растворителя (табл. 7).
Таблица 7. Эбуллиоскопические E и криоскопические K константы некоторых растворителей (град/моль)
| Растворитель | Е | K |
| 1. Вода | 0,516 | 1,86 |
| 2. Этиловый спирт | 1,23 | - |
| 3. Бензол | 2,57 | 5,12 |
| 4. Уксусная кислота | 3,1 | 3,9 |
| 5. Анилин | 3,69 | 5,87 |
Эбуллиоскопическая и криоскопическая константы растворителя показывают на сколько градусов повышается температура кипения и понижается температура замерзания раствора, полученного при растворении в одном килограмме растворителя одного моля неэлектролита (m = 1 моль/кг).
Для определения значений E и K сперва опытным путем определяют Dtкип. и Dtзам. сильно разбавленных растворов (m << 1), а затем полученные данные пересчитывают или экстраполируют для растворов с m = 1 моль/кг.
Значения E и K можно рассчитать и теоретически с помощью соотношения Вант-Гоффа:

где R – универсальная газовая постоянная; T – температура кипения растворителя; l - удельная теплота испарения растворителя.
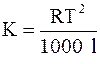
где T – температура плавления растворителя; l – удельная теплота плавления растворителя.
 2014-02-09
2014-02-09 6309
6309