Термодинамика химической коррозии. Химическая коррозия представляет собой самопроизвольное разрушение металлов в среде окислительного газа (например, кислорода, галогенов) при повышенных температурах или в жидкостях неэлектролитах.
Рассмотрим химическую коррозию в газах (газовую коррозию), в частности, коррозию в атмосфере кислорода. Уравнение реакции окисления металлов кислородом можно записать в общем виде:
nM + m/2O2 = MnOm
В соответствии с законами химической термодинамики эта реакция, как и другие реакции коррозии, может протекать лишь при условии уменьшения энергии Гиббса системы. Так как, по определению, энергия Гиббса простых веществ равна нулю, то энергия Гиббса окисления металлов равна энергии Гиббса образования оксидов. Энергию Гиббса реакции окисления рассчитывают по уравнению
ΔG = ΔG0- 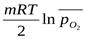 ,
,
где ΔG0- стандартная энергия Гиббса реакции; 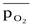 - относительное парциальное давление кислорода (р /100).
- относительное парциальное давление кислорода (р /100).
Стандартные значения ΔG0 приведены в справочниках. Для подавляющего большинства металлов стандартная энергия Гиббса их окисления ниже нуля, что говорит о возможности протекания этой реакции при атмосферном давлении кислорода.
Для большинства металлов условие ΔG0>0, при котором коррозия невозможна, проявляется при очень низких давлениях кислорода, не реализуемых на практике.
 2015-07-04
2015-07-04 2072
2072








