Ионы металла переходят в раствор на анодных участках в количестве химически эквивалентном реакции, протекающей на катодных участках. На анодных участках идет следующая реакция:
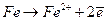 (1)
(1)
Скорость этой реакции в большинстве сред велика, о чем свидетельствует отсутствие поляризации при наложении внешнего анодного тока. Скорость коррозии железа обычно лимитируется катодной реакцией, которая, как правило, значительно медленнее (катодный контроль). В неаэрируемых растворах катодная реакция имеет вид
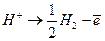 (2)
(2)
Эта реакция быстро протекает в кислой, но медленно в щелочной или нейтральной водной среде. Например, скорость коррозии железа в деаэрированной воде при комнатной температуре менее 0,005 мм/год. Скорость выделения водорода в этом случае зависит от наличия в металле примесей с низким водородным перенапряжением. На поверхности чистого железа также может выделяться водород, поэтому железо высокой чистоты корродирует в кислотах, но значительно медленнее, чем техническое.
Катодная реакция ускоряется в присутствии растворенного кислорода (так называемая реакция деполяризации)
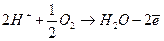 (3)
(3)
Растворенный кислород реагирует с атомами водорода, адсорбированными на поверхности железа. Реакция окисления протекает с той же скоростью, с какой 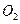 достигает поверхности металла.
достигает поверхности металла.
Суммируя (1) и (2) и учитывая реакцию 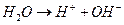 , получаем:
, получаем:
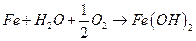 (4)
(4)
Гидратированный оксид железа FeO*nH2O или гидроксид железа 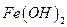 образуют на поверхности железа диффузионно-барьерный слой, через который должен диффундировать кислород. У раствора, насыщенного
образуют на поверхности железа диффузионно-барьерный слой, через который должен диффундировать кислород. У раствора, насыщенного 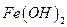 , pH = 9.5 так, что на поверхности железа, корродирующего в аэрированной чистой воде, среда всегда щелочная.
, pH = 9.5 так, что на поверхности железа, корродирующего в аэрированной чистой воде, среда всегда щелочная.
В сильных кислотах, например соляной, серной, диффузионно-барьерная оксидная пленка на поверхности железа растворяется при рН = 4. В более слабых кислотах, например уксусной или угольной, растворение оксида происходит при более высоком рН, поэтому скорость коррозии железа возрастает и начинается выделение водорода при рН = 5 или 6. Это различие объясняется большей общей кислотностью или нейтрализующей способностью частично диссоциированной кислоты по сравнению с полностью диссоциированной кислотой при данном рН.
Другими словами, при данном рН в слабой кислоте имеется большее число ионов 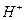 , способных реагировать и растворять барьерную оксидную пленку, чем в сильной кислоте.
, способных реагировать и растворять барьерную оксидную пленку, чем в сильной кислоте.
Возрастание скорости коррозии железа по мере уменьшения рН обусловлено не только увеличением скорости выделения водорода; в действительности облегченный доступ кислорода к поверхности металла вследствие растворения поверхностного оксида усиливает кислородную деполяризацию, что нередко является более важным фактором. В 6 % уксусной кислоте отношение скоростей коррозии в присутствии кислорода и в его отсутствие равно 87. В окисляющих кислотах, например в азотной, действующих как деполяризаторы, для которых скорость коррозии не зависит от концентрации растворенного кислорода, это отношение близко к единице. В общем, чем более разбавлена кислота, тем больше отношение скоростей коррозии в присутствии и в отсутствие кислорода. В концентрированных кислотах скорость выделения водорода так велика, что затрудняется доступ к поверхности металла.
Существенное деполяризующее воздействие растворенного кислорода означает, что скорость движения кислоты должна влиять на скорость коррозии. Так и происходит в действительности, особенно в разбавленных кислота. Ингибирующее действие растворенного кислорода проявляется в области критической скорости движения жидкости, которая тем выше, чем интенсивней в начальный период реагирует сталь с кислотой. Движение кислоты относительно металла сносит пузыри водорода и уменьшает толщину инертного слоя жидкости на поверхности металла, что позволяет большему количеству кислорода достичь поверхности. В соответствии с этим, при скорости движения 3,7 м/с сталь в 0,0043 н. 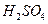 в присутствии кислорода корродирует с такой же скоростью, как и в 5 н.
в присутствии кислорода корродирует с такой же скоростью, как и в 5 н. 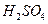 , а в неподвижной кислоте отношение скоростей коррозии около 12.
, а в неподвижной кислоте отношение скоростей коррозии около 12.
 2015-07-14
2015-07-14 1382
1382
