ЛАБОРАТОРНАЯ РАБОТА №3
«Исследование работы коррозионных элементов»
Цель работы: исследование коррозионной активности пары Cu-Sn, Cu-Cd, Cu-Zn и т.п., определение тока коррозии коррозионного элемента, используя модель коррозионного элемента с электродами макроскопических размеров.
Оборудование: два химических стакана на 200-250 мл., иономер И-130, вольтамперметр, магазин сопротивлений, два хлорсеребряных электрода, солевой мостик, электроды из меди, кадмия и олова.
Реактивы: раствор 0,5 н. NaCl, насыщенный раствор KCl.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Теория коррозионных элементов
Возникновение коррозионных элементов связано с дифференциацией поверхности металла на участки с более низким потенциалом и более высоким положительным потенциалом. Первые становятся благодаря этому анодными, вторые — катодными, и коррозия протекает с определенной локализацией коррозионных поражений.
В связи с таким распределением поверхности на анодные и катодные зоны схему коррозионного процесса можно представить в таком виде:
Анодная зона: Me = Me+ + e
Катодная зона: Ox + e = Red
Эти две самостоятельные стадии процесса коррозии — анодная и катодная, как и прежде, точно сбалансированы, т. е. все электроны, которые освобождаются в результате ионизации металла, должны быть связаны в ходе катодного процесса. Теоретически для данной цели пригодным является любой акцептор электронов, если его потенциал имеет более положительное значение, чем потенциал анодного процесса. На практике приходится встречаться с двумя случаями. В одном их них - электроны связываются в результате разряда водородных ионов, в другом — окислительным агентом, ассимилирующим электроны, служит растворенный кислород.
Таким образом, поверхность корродирующего металла, согласно теории микроэлементов, можно уподобить совокупности большого количества отдельных гальванических пар, замкнутых накоротко. Роль внешней цепи играет сам металл, по которому электроны от анодных участков перетекают к участкам с более положительным местным значением потенциала. В самом электролите происходит перенос ионов: анионы движутся к анодным участкам, катионы — по направлению к катодным участкам. Схема коррозионного процесса, обусловленного работой коррозионных пар, показана на рис. 1.
Рассмотрим ее подробнее. При переходе в раствор ионы металла гидратируются, и освобождающаяся энергия гидратации является движущей силой данного процесса. При переходе каждого иона металла в раствор определенное количество электронов остается в металле. Они перетекают по металлу к катодным участкам, потенциал которых более положителен. Там происходит их связывание частицей окислителя, которая при рассмотрении коррозионных процессов называется катодным деполяризатором D. Схема, приведенная на рис. 1., подчеркивает пространственное разделение мест, где протекает коррозия (анодных участков), и участков, на которых происходит ассимиляция притекающих электронов. В растворе электролита наблюдается перемещение электрически заряженных частиц — ионов, движущихся к катоду и аноду
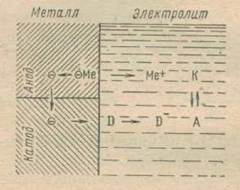
Рис.1. Принципиальная схема работы коррозионного элемента
под влиянием электростатического притяжения (миграция) и вследствие разности концентраций (диффузия). Явление диффузионного переноса вещества играет особо существенную роль в развитии коррозионного процесса, когда реакция на катоде протекает при участии электронейтральных молекул кислорода. Так как в результате электрохимического восстановления кислорода на катоде происходит образование ионов гидроксила, согласно реакции O2 + 2H2O + 4e ® 4OH-, раствор возле катодных участков защелачивается. Ионы гидроксила перемещаются по направлению к анодным участкам и, встречая на этом пути катионы металла, образуют осадок нерастворимой гидроокиси — вторичного продукта коррозионного процесса.
Какими же причинами может быть вызвано упомянутое разделение поверхности металла на анодные и катодные участки, приводящее к возникновению коррозионных пар?
Имеются следующие факторы, вызывающие возникновение электрохимической гетерогенности металлической поверхности:
1. Неоднородность металлической фазы. Ее причинами могут быть присутствие металлических и неметаллических включений, расслоение твердого раствора благодаря ликвации, накопление примесей по границам зерен, анизотропия свойств металлических кристалов и т. д. Неоднородность металлической фазы часто вызывает дефекты структуры окисной пленки на поверхности металла или же неравномерное распределение продуктов коррозии. Важную роль играют механические напряжения и деформация металла.
2. Неоднородность жидкой фазы, в которой протекает коррозионный процесс вследствие различия концентрации собственных ионов, рН, неравномерный доступ кислорода или же других окислителей.
3. Различие физических условий, например, температуры, давления, воздействия радиации, внешнего электрического поля.
Коррозионные пары можно классифицировать по их размеру. В этой связи различаются: а) макрокоррозионные пары, когда размеры их электродов достаточно большие (например, образуются при конструктивном сочетании деталей из разнородных металлов); б) микрокоррозионные пары (например, зерно кристалла — его граница).
 2015-07-14
2015-07-14 744
744







