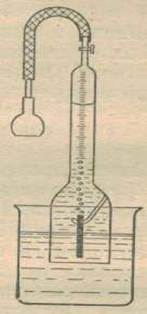
 Для проведения эксперимента по определению скорости коррозии цинка (или другого металла) собирают установку (рис. 1) – водородный коррозиометр. Он состоит из газовой бюретки, снабженной в нижней части расширением, внутри которого крючок для закрепления образца.
Для проведения эксперимента по определению скорости коррозии цинка (или другого металла) собирают установку (рис. 1) – водородный коррозиометр. Он состоит из газовой бюретки, снабженной в нижней части расширением, внутри которого крючок для закрепления образца.
Пластинку, подготовленную согласно пункту 2.2. подвешивают на крючок в водородном коррозиметре. Бюретка помещается в химический стакан с раствором кислоты и с помощью резиновой груши заполняется этим раствором. После того как вся установка собрана, отмечают время по секундомеру и соответствующее этому начальному моменту времени положение мениска жидкости в верхней части бюретки. В последующем отсчеты объемов производят через каждые 2 минуты в течение 25-30 минут. Полученные данные представляют в таблице 1 и отображают на графике «объём выделенного водорода-время». Если процесс протекает с постоянной скоростью, то объем выделенного водорода прямо пропорционален времени. Наклон прямой дает непосредственное значение скорости коррозии металла в растворе кислоты.
iкор.= tgα = 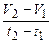
Рис.1. Водородный коррозиметр
Величину этой скорости следует выразить с помощью весового показателя скорости коррозии в мм/см2•мин, принимая во внимание размер образца.
На основе данных таблицы1, расчёт скорости коррозии производится исходя из объёма газа, собранного в бюретке за всё время опыта, что даёт среднее значение скорости коррозии.
Скорость коррозии можно определить и по потери массы металлической пластинки. Для этого после опыта её тщательно высушивают, взвешивают(m) и выражают скорость коррозии в г/см2•час.
Одной из возможных причин погрешности в оценке скорости коррозии в данном методе служит прилипание пузырьков водорода к стенкам бюретки. Чтобы избежать этого перед опытом необходимо тщательно промыть водородный коррозиметр хромовой смесью, тщательно ополаснуть сначала водопроводной, а затем дистиллированной водой, добиваясь полной смачиваемости внутренних стенок бюретки.
Таблица 1
Зависимость объёма выделившегося водорода от времени
при коррозии цинка в 1 н HCl
| № п/п | Объём выделившегося водорода V,мл | Время τ, мин |
| и т.д. |
Строят график V=f(τ) и расчитывают скорость коррозии.
КОНТРОЛЬНЫЕ ВОПРОСЫ
- Из каких стадий состоит коррозионный процесс?
- Какой процесс называют электрохимической коррозией?
- Механизм взаимодействия цинка с кислотами.
- Гальванический элемент Вольта.
- Механизм коррозии металла с кислородной деполяризацией.
- Что такое поляризация? Перенапряжение кислорода?
- Понятие диффузионного и кинетически-диффузионного контроля.
- Механизм коррозии металла с водородной деполяризацией.
- Влияние серной кислоты на коррозию металлов.
- Влияние азотной и соляной кислот на коррозию металлов.
- Влияние фосфорной и фтороводородной кислот на коррозию металлов.
- Влияние органических кислот на коррозию металлов.
- Методы защиты от коррозии.
 2015-07-14
2015-07-14 604
604








