Семейство коллагенов включает около 20 белков. Продуцируют коллаген в основном фибробласты соединительной ткани. Коллаген составляет около 30% от общего количества белка организма взрослого человека, или 6% от массы тела. Коллагеновые волокна являются характерным компонентом структуры соединительной ткани. Для коллагена характерен специфический аминокислотный состав. 1/3 всех аминокислотных остатков составляет глицин, 1/3 - пролин и 4-гидроксипролин, около 1% - гидроксилизин; некоторые формы коллагена содержат 3-гидроксипролин.
Молекулы коллагена образованы тремя полипептидными цепями, каждая из которых скручена в левую спираль, а это спирали, в свою очередь, скручены вместе в правую суперспираль. Структурный остаток Гли-X-Y, часто повторяющийся в первичной структуре полипептидных цепей коллагена, называется коллагеновым мотивом. Глицин обязателен, поскольку радикал любой другой аминокислоты не помещается между пептидными цепями в центре тройной спирали. X часто – пролин (или лизин), а Y – гидроксипролин (или другая аминокислота). Они ограничивают вращение полипептидной цепи.
Синтез коллагена происходит на полирибосомах ЭПР. С участием ферментов пролилгидроксилазы или лизилгидроксилазы гидроксилируются остатки пролина и лизина в растущих цепях при участии кислорода,
a-кетоглутарата, а также иона Fe2+ и аскорбиновой кислоты в качестве кофакторов (рис. 29). Гидроксилирование необходимо для образования связей между молекулами коллагена при сборке фибрилл.
По мере синтеза пептидные цепи с помощью сигнального пептида проникают через мембрану в полость ЭПР, там гликозилируются путем присоединения к некоторым остаткам гидроксилизина остатков моносахаридов и объединяются в молекулы проколлагена. Он перемещается в комплекс Гольджи, включается в секреторные гранулы и секретируется. В межклеточном пространстве при действии амино- и карбоксипептидаз от проколлагена отщепляются концевые пропептиды, и образуется тропоколлаген. Его тройная спираль стабилизирована водородными связями с участием остатков гидроксипролина и молекул воды (межфибриллярная структурная вода) и межцепочечными поперечными сшивками между лизиновыми и гидроксилизиновыми остатками.
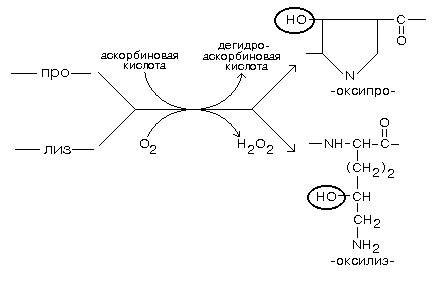
Рис. 29. Гидроксилирование остатков пролина и лизина в молекуле коллагена
Образование коллагеновых фибрилл происходит путем самосборки. Происходит дезаминирование лизина и гидроксилизина с образованием альдегидных групп. Они взаимодействуют с аминогруппами остатков лизина другой молекулы коллагена, в результате чего образуются межмолекулярные ковалентные сшивки (рис. 30).
Фибриллообразующие коллагены – коллагены I, II, III, V, XI. Существуют также коллагены, образующие сетевидные структуры, например, коллаген IV типа - основной структурный белок базальных мембран. Его пептидные цепи сохраняют концевые глобулярные домены и образуют сетевидную трехмерную структуру.
2. Эластин -основной белковый компонент, из которого состоят эластические волокна. Как и коллаген, эластин содержит много глицина и пролина. Оксипролина в эластине примерно в 10 раз меньше, чем в коллагене, нет гидроксилизина, много валина и других гидрофобных аминокислот.
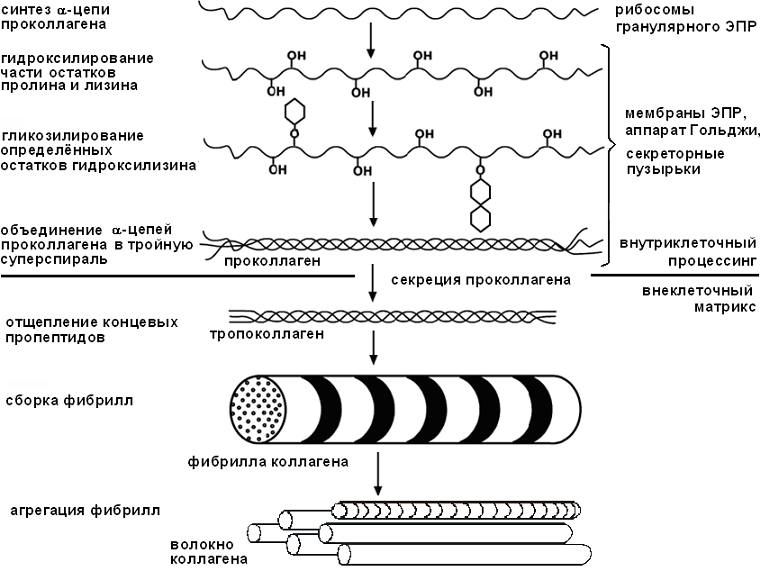
Рис. 30. Образование коллагеновых волокон
Пептидная цепь эластина имеет форму рыхлой глобулы. В межклеточном матриксе молекулы эластина соединены сшивками, в образовании которых участвуют остатки лизина. В результате получаются эластиновые волокна и слои. Эластин в отличие от других фибриллярных белков способен растягиваться в двух направлениях.
Эластин синтезируется фибробластами. Его предшественник - тропоэластин. Он не содержит поперечных связей, растворим. В последующем тропоэластин превращается в зрелый эластин, нерастворимый, содержащий большое количество поперечных связей. Его много в крупных кровеносных сосудах, связках, легких.
 2015-07-14
2015-07-14 3424
3424








