Основатель этого метода – немецкий физик Кольрауш, который впервые в 1885 г. предложил уравнение зависимости электропроводности растворов сильных электролитов от концентрации. Электропроводность растворов обусловлена диссоциацией растворенного вещества и миграции образующихся ионов под действием внешнего источника напряжения.
Движущиеся ионы в поле электрического тока испытывают тормозящее действие со стороны молекул растворителя – релаксационный эффект – и со стороны противоположно заряженных ионов – электрофоретический эффект. В результате этих торможений раствор оказывает сопротивление прохождению электрического тока. То есть электропроводность (W) – это величина обратная сопротивлению:
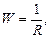 сименс (См = Ом-1). (37)
сименс (См = Ом-1). (37)
Зависимость электропроводности от концентрации выражается уравнением
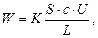 (38)
(38)
где K – коэффициент пропорциональности;
S – площадь электродов; с – концентрация ионов;
U – подвижность ионов; L – расстояние между электродами.
Для данной пары электродов при S, L = const получим:
W = K ⋅ c ⋅ U. (39)
Различают удельную (æ, каппа) и эквивалентную электропроводность (λ).
Удельная электропроводность (æ) – это электропроводность 1 см3 раствора, находящегося между электродами площадью 1 см2 каждый, расположенными на расстоянии 1 см друг от друга. Размерность: См/м.
Эквивалентная электропроводность (λ) – это электропроводность 1н раствора электролита, измеренная при расстоянии L = 1 см. Размерность: См ⋅ г ⋅ экв-1 ⋅ см 2.
Зависимость æ и λ выражается уравнением
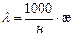 , (40)
, (40)
где н – нормальная концентрация.
Таким образом, в кондуктометрии аналитическим сигналом является электропроводность.
Различают: прямую кондуктометрию и кондуктометрическое титрование.
 2015-07-14
2015-07-14 1557
1557








