Существует ряд методов измерения адсорбционной способности веществ.
а) В случае подвижной поверхности раздела жидкость-газ величину адсорбции (Г) можно определить по изменению поверхностного натяжения. Для этого при постоянной температуре измеряют поверхностное натяжение для растворов разных концентраций и вычеркивают изотерму поверхностного натяжения (σ) (рис. 2.15, кривая 1). Подставив полученные в эксперименте значения σ в уравнение Гиббса, затем можно установить количество адсорбированного вещества в каждой точке и построить изотерму адсорбции Г (кривая 2), которая будет стремиться к пределу – Г∞ , характеризующему полное насыщение поверхностного слоя частичками адсорбируемого вещества. Экстраполируя Г∞ на ось ординат, получают величину адсорбции Г.
 |
б) При конкретной концентрации вещества СА на границе жидкость-газ величину Г можно найти через поверхностную активность как
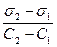 или как тангенс угла, образованного касательной к точке А, на изотерме поверхностного натяжения с осью абсцисс (рис. 2.16). Подставив экспериментальную величину поверхностной активности в уравнение Гиббса можно рассчитать значение адсорбции Г.
или как тангенс угла, образованного касательной к точке А, на изотерме поверхностного натяжения с осью абсцисс (рис. 2.16). Подставив экспериментальную величину поверхностной активности в уравнение Гиббса можно рассчитать значение адсорбции Г. Измерение адсорбции по изменению поверхностного натяжения или поверхностной активности в жидкостях удобно, но применимо преимущественно для ПАВ резко изменяющих поверхностное натяжение.
в) Для определения адсорбции на границе раздела твердое тело-жидкость, т.е. при адсорбции из растворов, Фрейндлихом было предложено эмпирически найденное уравнение:
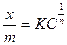 , где
, где
x – количество адсорбированного вещества;
m – количество адсорбента;
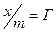 – количество вещества, адсорбированного единицей массы адсорбента;
– количество вещества, адсорбированного единицей массы адсорбента;
С – равновесная концентрация адсорбтива;
К и n – эмпирические константы.
Представленному уравнению соответствует параболическая изотерма адсорбции Фрейндлиха (рис. 2.17,а). Для нахождения величин эмпирических констант уравнение логарифмируют, переводя его в линейную форму:
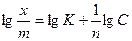 .
.
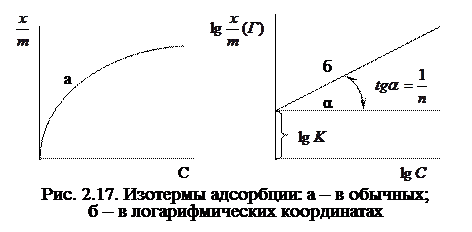 В координатах
В координатах 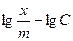 изотерма принимает вид прямой (рис.2.17,б), отсекая на оси ординат отрезок, равный
изотерма принимает вид прямой (рис.2.17,б), отсекая на оси ординат отрезок, равный 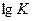 . Тангенс угла наклона прямой к оси абсцисс дает значение второй константы -
. Тангенс угла наклона прямой к оси абсцисс дает значение второй константы - 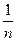 . Подстав-
. Подстав-
ляя полученные константы в уравнение Фрейндлиха, вычисляют величины адсорбции Г для заданной области концентраций.
Уравнение Фрейндлиха и соответствующая ему парабола имеют определенные недостатки. Они не описывают прямолинейного нарастания адсорбции при низких концентрациях адсорбтива, как это следует из типичной экспериментальной изотермы (рис. 2.6), а также предельного значения адсорбции, когда дальнейшее увеличение концентрации адсорбтива не влияет на конечный процесс.
г) Позднее Ленгмюр вывел простейшее уравнение адсорбции для случая накопления газа на твердой поверхности. Вывод уравнения Ленгмюра базируется на ряде исходных предпосылок:
- адсорбция молекул адсорбтива происходит только на адсорбционных центрах поверхности адсорбента. При малых давлениях газа заполняется лишь часть поверхности, соответствующая адсорбционной способности газа;
- все адсорбционные центры энергетически равноценны и каждый может удерживать только одну молекулу адсорбтива. В итоге формируется мономолекулярный слой адсорбированных молекул;
- адсорбированные молекулы находятся на адсорбционных центрах в течение определенного времени, после чего десорбируются в газовую фазу. При равенстве скоростей обоих процессов в системе устанавливается динамическое адсорбционно-десорбционное равновесие:
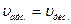 ,
,
где: 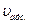 - скорость адсорбции;
- скорость адсорбции; 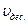 - скорость десорбции.
- скорость десорбции.
Приняв число адсорбционных центров поверхности за единицу и обозначив долю адсорбционных центров, занятую адсорбированными молекулами, через х, для свободных (незанятых) центров, получим (1-х). В соответствии с законом действующих масс скорость адсорбции пропорциональна давлению газа (ρ) и числу свободных центров (1-х):
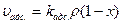 ,
,
где 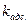 - константа скорости адсорбции.
- константа скорости адсорбции.
Скорость десорбции зависит только от числа адсорбированных молекул и пропорциональна доле занятых центров (х):
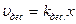 ,
,
где 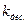 - константа скорости десорбции.
- константа скорости десорбции.
При адсорбционном равновесии:
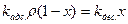 ;
;
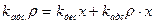 ;
;
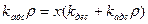 ;
;
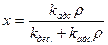
разделив числитель и знаменатель правой части уравнения на 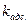 , можно записать:
, можно записать:
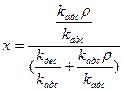 ;
;
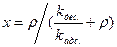 .
.
Поскольку отношение констант скоростей десорбции и адсорбции есть константа (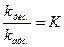 - константа адсорбтивного равновесия), а величина х по своему физическому смыслу равна отношению количества адсорбированного вещества (Г) к предельно возможному (Г∞) (
- константа адсорбтивного равновесия), а величина х по своему физическому смыслу равна отношению количества адсорбированного вещества (Г) к предельно возможному (Г∞) (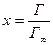 ), то заменив
), то заменив 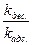 на К, а х на
на К, а х на 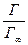 уравнение примет вид:
уравнение примет вид:
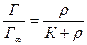 .
.
Отсюда получаем уравнение адсорбции Ленгмюра: 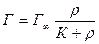 , уравнение гиперболы (рис. 2.6) с асимптотой
, уравнение гиперболы (рис. 2.6) с асимптотой 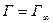 .
.
Выведенное уравнение оказалось общим и справедливым для широкого интервала концентраций веществ, а также поверхностей раздела как неподвижных (твердое тело-газ, твердое тело-жидкость), так и подвижных (жидкость-газ, жидкость-жидкость).
В случае адсорбции из раствора в уравнение вместо давления газа (ρ) вводится значение равновесной концентрации растворенного вещества (С):
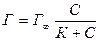 .
.
Анализ уравнения Ленгмюра показывает, что, в зависимости от концентрации адсорбтива, оно принимает различные формы. При малых концентрациях, когда 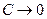 , этой величиной в знаменателе можно пренебречь, тогда:
, этой величиной в знаменателе можно пренебречь, тогда:
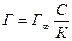 .
.
Согласно данному выражению, адсорбция растет линейно с увеличением концентрации, подчиняясь закону Генри. На графике изотермы адсорбции (рис. 2.6) такому условию соответствует начальный участок кривой (1).
В области больших концентраций, наоборот, можно пренебречь относительно малым слагаемым К, тогда:
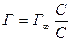 ,
,
а после сокращения Г станет равным Г∞ . Полученное равенство указывает на предельно возможное насыщение поверхности адсорбтивом, т.е. на образование мономолекулярного слоя адсорбируемого вещества на границе раздела фаз. Данному состоянию соответствует горизонтальный линейный участок 3 рис. 2.6, на котором величина адсорбции уже не зависит от концентрации или давления.
В области средних концентраций растворенных веществ или давлений газа уравнение Ленгмюра сходно с уравнением Фрейндлиха и отвечает параболическому участку изотермы адсорбции – кривая 2, рис. 2.6.
При определении величин К и Г∞ используют линейную форму уравнения Ленгмюра. Для этого делят единицу на обе части уравнения, получая уравнение типа 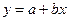 :
:
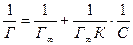 .
.
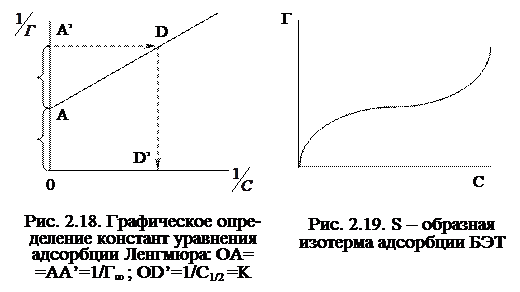 В координатах
В координатах 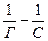 гиперболическая изотерма адсорбции представляет собой прямую (рис. 2.18), отсекающую на оси ординат отрезок, равный
гиперболическая изотерма адсорбции представляет собой прямую (рис. 2.18), отсекающую на оси ординат отрезок, равный 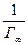 . Вторая константа К численно равна величине обратной той равновесной концентрации, при которой молекулами адсорбтива занята половина адсорбционных центров поверхности адсорбента: т.е. Г= Г∞ . Для нахождения К на оси ординат вверх от точки А (рис.2.18) откладывают отрезок, равный ОА. Проведя через полученную точку А’ горизонтальную линию, до пересечения с изотермой в точке D, и опустив из точки D перпендикуляр на ось абсцисс, находят точку D’ соответствующую значению
. Вторая константа К численно равна величине обратной той равновесной концентрации, при которой молекулами адсорбтива занята половина адсорбционных центров поверхности адсорбента: т.е. Г= Г∞ . Для нахождения К на оси ординат вверх от точки А (рис.2.18) откладывают отрезок, равный ОА. Проведя через полученную точку А’ горизонтальную линию, до пересечения с изотермой в точке D, и опустив из точки D перпендикуляр на ось абсцисс, находят точку D’ соответствующую значению 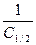 , равному константе К (
, равному константе К (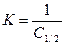 ).
).
Если известны величины Г∞ и S0 – площадь, занимаемая одной молекулой газа или ПАВ в насыщенном монослое, то можно рассчитать удельную поверхность Sуд – одну из важнейших характеристик твердого адсорбента:
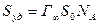 .
.
д) В случае, когда при высоких концентрациях адсорбтива адсорбция заканчивается образованием не моно-, а полимолекулярного адсорбционного слоя, уравнение адсорбции Ленгмюра и соответствующая ему изотерма становятся неприменимыми. Более точными в таких случаях оказываются S-образные изотермы Брунауэра, Эммета и Теллера (сокращенно БЭТ), одна из которых представлена на рис. 2.19. Изотерме адсорбции Ленгмюра соответствует только нижняя часть S-образной кривой. Изотермы БЭТ используются в расчетах адсорбции газа или пара на твердых поверхностях.
 2015-07-14
2015-07-14 5071
5071
