Рассмотрим гомогенные системы, в которых реагенты находятся в одной фазе (газовой или жидкой) и в которой диффузионные процессы не влияют на скорость превращения.
В таких случаях скорость превращения определяется скоростью химического превращения. По i- му компоненту продуктов в расчете на единицу объёма системы её можно выразить следующим образом:
w =- 
 =-
=- 
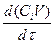 =-
=- 
 =-
=- 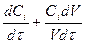
где Сi--концентрация реагента.
Если реакция проходит при постоянном объеме уравнение упрощается до вида
w =- 
 =
= 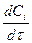 w =-
w =- 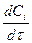 (24)
(24)
Для идеальных газов
w =- 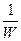

 =
= 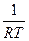
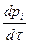 (25)
(25)
Скорость процесса можно выразить также изменением степени превращения Х.
w = 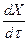 (26)
(26)
Так как истинная скорость процесса во многом зависит от типа реактора (которые мы будем рассматривать позже) поэтому рассмотрим основные формулы скорости процесса лишь в общем, виде.
1. Для гомогенных преобразований и гетерогенных процессов при неизвестной поверхности соприкосновения фаз
ω = kVΔC или ω = kΔC
(27)
2. Для гетерогенных процессов, т.е. при фазовом переходе веществ, когда известно значение поверхности раздела, скорость процесса обычно выражают уравнением Ньютона для теплопередачи:
ω = kFΔC
(28)
где k- константа скорости процесса;
ΔС- движущая сила процесса;
V- реакционный объём.
F-поверхность соприкосновения реагирующих фаз;
Константа или коэффициент скорости процесса представляет собой сложную величину. Она зависит не только от химических свойств реагирующих веществ, но и от физических характеристик, конструкции аппарата, скорости потоков, перемешивания, диффузии реагирующих веществ.
Если в гомогенных процессах при хорошем перемешивании диффузия протекает очень быстро, то в гетерогенных системах диффузия, как правило – самая медленная стадия, определяющая общую скорость всего процесса. Поэтому константа скорости в этом случае определяется как
K = D/ δ
где D – коэффициент диффузии;
δ –толщина диффузионного слоя.
Если процесс протекает в переходной области, то константа скорости должна учитывать и диффузионные (D) и кинетические (К) этапы так что:
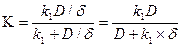
То есть возникают дополнительные торможения процесса.
Поэтому технологи стремятся по возможности перевести процессы из диффузионной или переходной области в кинетическую, применяя интенсивное перемешивание реагентов.
Движущая сила процесса ΔС
Для гомогенных реакций определяется по закону действующих масс как произведение концентраций реагирующих веществ в данный момент. Для простой необратимой реакции

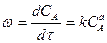
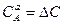
Однако такого типа реакции редки в производственных условиях. Уравнение пригодно когда скорость процесса определяется концентрацией вещества А в следствии избытка остальных реагентов т.е. гидратация, гидролиз окисление кислородом воздуху и.т.п.
 2015-07-14
2015-07-14 520
520








