Повышение скорости технологического процесса и соответствующее повышение производительности аппаратуры является основной задачей технологии.
Для повышения скорости процесса как это следует из формул необходимо увеличивать определяющие параметры К, ΔС, и F. Как правило, существует всегда несколько способов их увеличения, поэтому выбирают наиболее рациональные т.е. требующие наименьших производительных затрат для достижения поставленной цели.
Увеличение константы скорости процесса достигается в основном тремя путями.
1. – повышение температуры взаимодействующей системы.
2. – применением катализаторов;
3. – усилением перемешивания реагирующих масс.
1. Повышение температуры приводит к сильному увеличению констант скорости и в меньшей степени к увеличению коэффициентов диффузии. В результате суммарная скорость любого процесса увеличивается при повышении температуры до некоторого предела, при котором большое значение приобретают скорости обратной или побочной реакций.
Для большинства процессов протекающих в кинетической области, зависимость константы скорости реакции от температуры определяется уравнением Аррениуса.
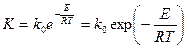 (33)
(33)
где К0 –предэкспоненциальный множитель, Е - энергия активации т.е. та минимальная энергия которой должны обладать молекулы для того чтобы прошло взаимодействие (Дж/моль) R- молекулярная газовая постоянная Дж(моль ·град); е – основание натуральных логарифмов.
Для расчетов это уравнение преобразуют к видам:
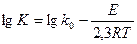 (34) или
(34) или 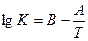 (35)
(35)
где – А и В постоянные
или преобразуют для двух различных температур
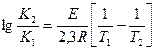
 (36)
(36)
Таким образом, при известных значениях Е и К1 можно определить к2 при любой другой температуре Т2 в пределах постоянства Е и потом вычислить температурный коэффициент скорости реакции.
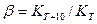
Однако температурный коэффициент скорости реакции не постоянный и существенным образом уменьшается с повышением температуры.
Как видно из уравнений (34) и (35) скорость прямой реакции с повышением температуры должна все время увеличиваться. Тем не менее, на практике не всегда можно беспредельно увеличивать температуру для его интенсификации.
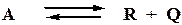
Скорость простой необратимой экзотермической реакции:
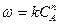

Из которой следует, что при С = const и увеличения температуры Т скорость реакции возрастает по экспоненциальному закону:
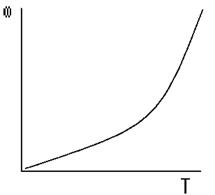
Рис.4 Зависимость скорости реакции ω от температуры Т, для простой необратимой реакции типа 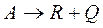
Зависимость скорости простой обратимой экзотермической реакции типа

от температуры выражается больше сложным уравнением, так как в этом случае общая скорость реакции зависит от разности между скоростями прямой и обратной реакции.
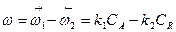 (37)
(37)
где 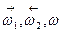 – скорость прямой, обратной и суммарной реакции.
– скорость прямой, обратной и суммарной реакции.
Для анализа уравнения (5) выразим концентрации реагентов через степени превращения:
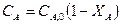 ,
, 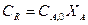 ,
,  ,
, 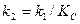
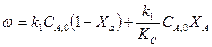
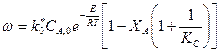 (38)
(38)
Из уравнения (38) следует, что при некоторой постоянной ХА с повышением температуры суммарная скорость реакции с одной стороны должна возрастать за счет увеличения е- Е / RT, а с другой стороны снижаться, так как для экзотермических реакций константа равновесия уменьшается при повышении температуры и уменьшается множитель в квадратных скобках.
При низких температурах действительный выход определяется скоростью прямого процесса 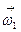 (к1) и поэтому растёт с повышением температуры, при высоких температурах скорость обратного процесса
(к1) и поэтому растёт с повышением температуры, при высоких температурах скорость обратного процесса 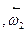 (к2) увеличивается быстрее чем
(к2) увеличивается быстрее чем 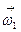 и выход Х ограниченный равновесием, снижается с увеличением Т. Для данных условий процесса имеется оптимальная температура Топт, которой соответствует наибольшая суммарная скорость процесса и максимальный выход продукта.
и выход Х ограниченный равновесием, снижается с увеличением Т. Для данных условий процесса имеется оптимальная температура Топт, которой соответствует наибольшая суммарная скорость процесса и максимальный выход продукта.
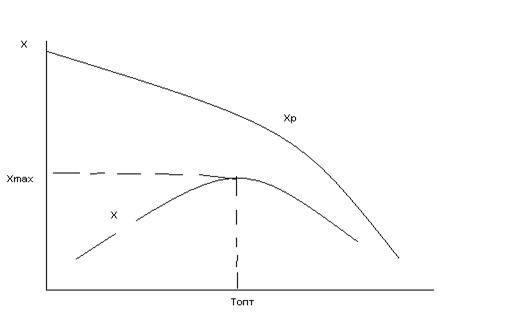
Рис.5 Зависимость выхода продуктов от температуры для обратимой экзотермической реакции:
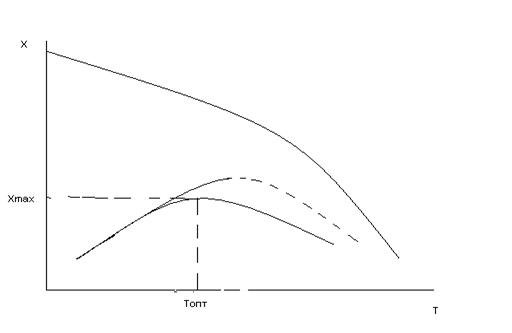
Рис.6 Зависимость выхода продукта от температуры для процесса сопровождается побочными реакциями (Р,Т,τ = const).
Иногда, особенно в технологии органических веществ суммарная скорость процесса проходит через максимум, при температуре меньшей, чем для равновесных процессов, так как при повышении температуры ускоряются побочные процессы в ущерб основному. Учитывая это в аппаратах, устанавливают экономически рациональную температуру.
Скорость реакций имеет сильное большое значение для достижения максимальной производительности и экономической эффективности производства. Она обуславливает почти все показатели, которые влияют на размеры и производительность аппаратуры. Скорость технологичного процесса является суммарной величиной скоростей прямой, обратной и побочных реакций, а также диффузии исходных веществ в зону реакции и продуктов реакции из этой зоны.
По рассмотренным закономерностям равновесия можно определять лишь максимально возможные теоретические выходы продукта. В производственных процессах обычно его достичь невозможно, поскольку суммарная скорость процесса с приближением к равновесию значительно уменьшается благодаря снижению концентрации исходных веществ.
В связи с тем, что на скорость химических процессов влияют разнообразные факторы и даже незначительные примеси, которые могут быть в сырье, результаты расчетов на основе законов и положений химической кинетики часто значительно расходятся с данными производства.
Изучая скорость химико-технологичного процесса, прежде всего надо расчленить его на простые составные части (стадии) и установить, как проходитпроцесс по стадиям — гомогенно или гетерогенно.
Скорость процесса в целом определяется скоростью наиболее медленной его стадии. Поэтому изучение кинетики отдельных стадий процесса дает возможность установить, на какую именно из них надо, прежде всего, обратить внимание, чтобы ускорить процесс в целом.
Большая часть гетерогенных (некаталитических) процессов проходит намного медленнее, чем гомогенных. В промышленной практике распостранены реакции в таких системах: жидкость—жидкость (Ж—Ж), жидкость — твердая фаза (Ж — Т), жидкость — газ (Ж- Г), газ — газ (Г –Г) газ — твердая фаза (Г — Т ), газ — жидкость — твердая фаза (Г — Ж — Т) и твердая фаза — твердая фаза (Т — Т).
Практически в промышленности гомогенные среды встречаются очень редко. Во всяком, даже химически чистом веществе, есть какая-то доля примесей, которые находятся в другой фазе. Поэтому лишь условно можно считать гомогенными те производственные процессы, протекающие в газообразном или жидком состоянии. Поскольку, в гомогенных системах реакции протекают быстрее, чем в гетерогенных, технологи стараются хотя бы некоторые стадии гетерогенных процессов осуществить в гомогенной системе. Этазакономерность не распространяется на гетерогенные каталитические процессы, многие из которых протекают с очень большой скоростью. Скорость гомогенных реакций зависит от концентрации температуры реагирующих веществ, применяемых катализаторов и других факторов. Скорость гетерогенных процессов, кроме того, зависит от размера поверхности контакта реагентов, скорости диффузии и т.д..
В гетерогенных системах, которые состоят из двух или более фаз, реагирующие компоненты находятся в разных фазах, поэтому во время гетерогенных процессов вещества проходят через поверхность раздела фаз.
Для ускорения химических процессов широко используются такие физико-химические и технические средства: увеличение концентрации реагентов, отвод конечных продуктов из зоны реакции, создание оптимального температурного режима, увеличение поверхности соприкосновения реагентов и применение катализаторов.
Скорость реакции определяется количеством полученного вещества в единицу времени. В начале процесса это довольно значительная величина, которая при приближении к состоянию равновесия уменьшается и стремится к нулю.
В соответствии с законом действующих масс (р,t = const) в изолированной системе количество продукта G, который образуется, изменяется во времени по восходящей логарифмической кривой.
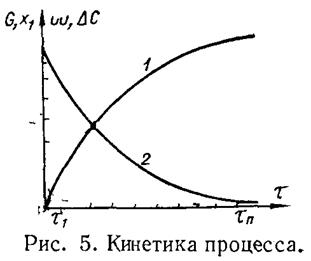
По аналогичной кривой изменяется и выход продукта х. Скорость реакции 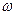 , которую выражают количеством продукта, образовавшегося за единицу времени (падающая кривая); в начале процесса довольно большая, а спустя некотороевремя сильно падает. Рис. 5. Кинетика процесса. При приближении к равновесию или при снижении концентрации исходных веществ в необратимых процессах скорость реакции и движущая сила ∆Сстремится к нулю.
, которую выражают количеством продукта, образовавшегося за единицу времени (падающая кривая); в начале процесса довольно большая, а спустя некотороевремя сильно падает. Рис. 5. Кинетика процесса. При приближении к равновесию или при снижении концентрации исходных веществ в необратимых процессах скорость реакции и движущая сила ∆Сстремится к нулю.
Для количественной оценки интенсивности работы разных аппаратов и для технологических расчетов производственных процессов лучше пользоваться не выходом продукта х, а константой скорости процесса к, которая в гетерогенных процессах называется коэффициентом массопередачи.
Константа скорости процесса в отличие от выхода не зависит от времени τ и концентрации реагирующих веществ С, а ее зависимость от температуры легко определяется по уравнению Аррениуса
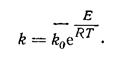 (39)
(39)
где — 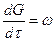 суммарная скорость процесса, определенная дифференциалом увеличение количества продукта dG за время dτ; k - константа скорости процесса, которая является функцией нескольких факторов (прежде всего температуры), которые влияют на процесс; F поверхность контакта реагирующих фаз; ∆С движущая сила процесса.
суммарная скорость процесса, определенная дифференциалом увеличение количества продукта dG за время dτ; k - константа скорости процесса, которая является функцией нескольких факторов (прежде всего температуры), которые влияют на процесс; F поверхность контакта реагирующих фаз; ∆С движущая сила процесса.
Константа, или коэффициент скорости процесса, является сложной величиной, которая зависит от химических и физических свойств реагирующих веществ, конструкции аппарата, скоростей потоков реагирующих масс, степени перемешивания компонентов в гомогенной среде. Для гомогенных процессов диффузия не имеет существенной роли. Протекание процесса проходит в кинетической области. Для гетерогенных процессов диффузия во многих случаях, прежде всего, ограничивает скорость процесса, т.е. процесс проходит в диффузионной области.
Для повышения скорости процесса надо найти способы увеличения определяющих величин — движущей силы ∆ с, константы скорости реакции ки поверхности контакта реагирующих веществ F.
Увеличение движущей силы ∆ с процесса достигается увеличением концентрации реагирующих компонентов в исходных материалах (сырье), повышением давления, отводом продуктов из зоны реакции. Способ увеличения концентрации компонентов в исходном сырье зависит от агрегатного состояния материала и связан с обогащением сырья.
Важным фактором, который влияет на скорость реакции, является энергия активации молекул, которая определяет ту часть столкновений молекул, которая приводит к реакции. Реакции будет идти тем интенсивнее, чем большей будет концентрация молекул и чем меньшей будет энергия их активации.
Повышение концентрации реагентов предопределяет не только ускорение реакций, а и уменьшение объема аппаратуры, производственных площадей, экономию транспорта, материалов и т. п.
Повышение давления влияет как на скорость процесса, так и на состояние равновесия. Наиболее сильно давление влияет на скорость процессов, которые протекают в газовой фазе или между газами и жидкостями или твердыми телами. Иногда повышенным давлением пользуются для замедления процессов разложение исходных веществ и выделения газообразных продуктов реакции. С увеличением давления увеличивается коэффициент теплопередачи, т.е. увеличивается степень использования тепла. В отдельных случаях увеличение давления приводит к совсем другим результатам, как, например, в процессах газификации твердого топлива.
Без применения давления некоторые процессы химической технологии вообще нельзя реализовать, как, например, синтез NН3, СН3ОН, полиэтилена, гидрирования угля и др. Применение сверхвысокого давления дает возможность осуществлять процессы без катализаторов.
Количественное влияние давления определятся кинетическими уравнениями.
Скорость реакции в газовом состоянии пропорциональна давлению в степени, равной порядку реакции. Наибольшее влияние давления на реакции высокого порядка, но с увеличением давления может изменяться порядок реакции п и уменьшаться константа скорости к. Кинетическое уравнение зависимости скорости реакции от давления имеет такой вид:
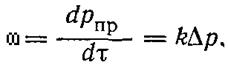 (40)
(40)
где 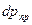 — парциальное давление продукта в газовой смеси; ∆р - движущая сила процесса. для модельной реакции, если она необратимая или протекает вдали от состояния равновесия, ω
— парциальное давление продукта в газовой смеси; ∆р - движущая сила процесса. для модельной реакции, если она необратимая или протекает вдали от состояния равновесия, ω
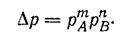 (41)
(41)
для адсорбции, абсорбции, конденсации и других процессов превращения газообразных компонентов в твердую или жидкую фазу по аналогии с уравнением (41) скорость ω
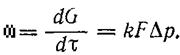 (42)
(42)
Если процесс необратим или далек от равновесия, то
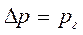 (43)
(43)
где рг — парциальное давление компонента в газовой фазе;
∆р — движущая сила процесса.
Для процессов десорбции газов и испарения жидкостей ускорение процесса и увеличение выхода достигается снижением давления, т.е. применением вакуума.
В твердофазных процессах, в связи с незначительной сжимаемостью твердых тел, эффективными будут только сверхвысокие давления, которые предопределяют перестройку электронных оболочек атомов, деформацию молекул и сдвиг фазового равновесия. Таким путем из углерода, растворенного в расплавленных металлах, при сверхвысоких давлениях до 1010 Па и температурах до 2400°С получают искусственные алмазы.
Наиболее эффективным средством изменения константы скорости реакции является изменение температурного режима системы.
Температура является сильнейшим фактором ускорения реакции. Повышение температуры влияет на скорость реакции и на равновесие химико-технологических процессов, которые протекают как в кинетической, так и в диффузионной области. Влияние температуры на процессы, которые протекают в кинетической области, зависит от теплового эффекта реакции.
(зависимость скорости химической реакции от температуры характеризуется температурным коэффициентом скорости реакции, которая является отношением констант скорости реакции при температурах, разность между которыми равна 10°С
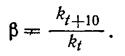 (44)
(44)
Практически при повышении температуры на 10°С скорость реакции увеличивается приблизительно в 2-4 раза. Чем больше энергия активации, тем выше температурный коэффициент. Это не совсем точное правило Вант-Гоффа применимо только для небольшого интервала температур (0—400° С).
Повышение температуры наиболее сильно влияет на процессы, которые связаны с эндотермическими обратимыми реакциями, поскольку согласно с принципом Ле Шателье при этом увеличивается равновесный выход и ускоряется реакция, т.е. уменьшается время для достижения равновесия.
Примером повышение равновесного выхода х с ростом температуры может быть эндотермическая реакция синтеза NО из элементов
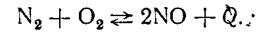 (45)
(45)
Зависимость равновесной концентрации х от температуры такая:
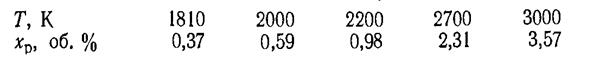
Для большинства процессов, которые протекают в кинетической области, влияние температуры на константу скорости реакции определяется уравнением Аррениуса (43), которое после логарифмирования имеет такой вид (для двух температур):
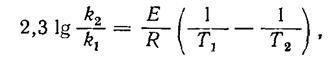 (46)
(46)
где к 1,к2 константы скорости реакции при соответствующих абсолютных температурах Т1, Т2.
Пользуясь этим уравнением при известных Е и к 1 и определенной температуре Т1, можно найти к2 при какой ни будь температуре Т2, а потом вычислить температурный коэффициент скорости реакции.
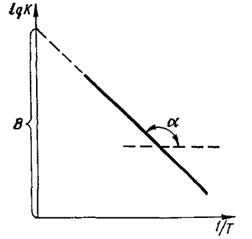
Рис. 6. Зависимость логарифма константы скорости от температуры
Зная температурный коэффициент реакции, по уравнению Аррениуса определяют энергию активации.
В соответствии с уравнением (43) можно графически выразить зависимость константы скорости реакции от температуры (рис. 6). Прямолинейный характер этой зависимости дает возможность определить константу скорости реакции при любой температуре по прямой, построенной по двум известным точкам. По этому же графику, зная значение к при разных температурах, можно определить энергию активации Е, поскольку 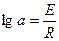 а также постоянную интегрирования
а также постоянную интегрирования 
В некоторых случаях уравнение Аррениуса записывают в виде
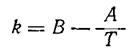 (48)
(48)
с постоянными коэффициентами А и В, которыесправедливы только для данной реакции в пределах практического постоянства температурного коэффициента.
Коэффициент  определяют експериментально,
определяют експериментально, 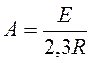 вычисляют или тоже определяют экспериментально.
вычисляют или тоже определяют экспериментально.
При повышениитемпературы обратимые реакции ускоряются вследствие увеличения константы скорости прямой реакции, тогда как равновесие экзотермических реакций смещается в сторону исходных продуктов.
Экзотермические обратимые реакции, которые ныне преобладают в процессах химических производств, ускоряются при повышении температуры лишь в результате увеличение константы скорости прямой реакции (по формуле Аррениуса). Скорость обратной эндотермической реакции при увеличении температуры, начиная с некоторого момента, возрастает быстрее, чем прямой, вследствие чего выход продукта х повышается с ростом температуры лишь до некоторого предела (максимума), который отвечает оптимальной температуре. При повышении температуры выше оптимальной выход продукта падает так же, как и равновесный. Такой вид зависимости выхода продукта от температуры характерный для многих производственных обратимых реакций — окисление S02 в SО3, конверсии СО и др.
Влияние температуры на скорость процессов в диффузионной области проявляется в увеличении коэффициента диффузии Dи соответственно коэффициента массопередачи к с повышением температуры. Это видно из уравнения скорости гетерогенного процесса (46)в диффузионной области, для которой 
В связи с тем, что температурный коэффициент скорости реакции больше чем температурный коэффициент диффузии, некоторые химико-технологические процессы (например, газификация топлива, обжиг сульфидных руд) при повышении температуры переходят из кинетической области в диффузионную. Влияние температуры на фазовое состояние имеет большое значение для многих процессов химической технологии. Высокие температуры иногда являются единственным средством практического осуществления многих «твердофазных» процессов. К таким процессам можно отнести спекание и сплавление в производстве вяжущих материалов, керамики, глинозема и др.
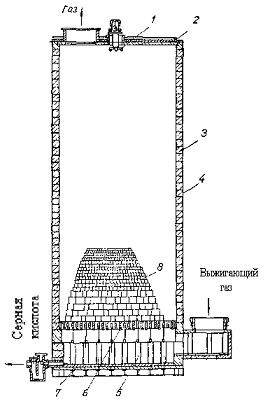
Рис. 6. Башня с насадкой
1-звезда-разбрызгиватель жидкости; 2-корпус; 3-футеровка; 4-стальной корпус; 5-опора колосниковой решетки; 6-колосники; 7-днище; 8-насадка.
Большую роль в технологии имеет переход хотя бы части материала в жидкую или газовую фазу, которая резко увеличивает скорость диффузии и поверхность контакта фаз. Много реакций, которые в жидкой фазе проходят в несколько стадий, удалось осуществить непосредственно в газовой фазе на твердых катализаторах при высоких температурах.
Это прямая гидратация этилена, прямое восстановление нитробензола в анилин ит.д.Каталитические реакции в газовом состоянии можно проводить беспрерывно, циклично, с минимальными затратами и с полной автоматизацией процессов.
Хотя повышение температуры положительно сказывается на химико-технологическом процессе, применение высоких температур для его интенсификации часто ограничивается ризными технологическими иэкономическими факторами: быстрым достижением равновесия экзотермических реакций, материалами аппаратуры и э кономично невыгодными затратами энергии для нагревания реагирующих компонентов.
Скорость гетерогенного процесса пропорциональна поверхности соприкосновения фаз
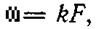 (49)
(49)
где ω скорость реакции; F — удельная поверхность; k— коэффициент пропорциональности.
Удельная поверхность- это отношение абсолютной поверхности к единице массы или объема той фазы, которая содержит реагент. Увеличение поверхности контакта фаз в технологии достигается разными способами в зависимости от вид вида системы:
Г — Ж, Г—Т, Ж—Т, Ж—Ж (которыене смешиваются) и Т — Т, а также в зависимости от температуры, давления, концентрации и катализатора, который используют в этом процессе.
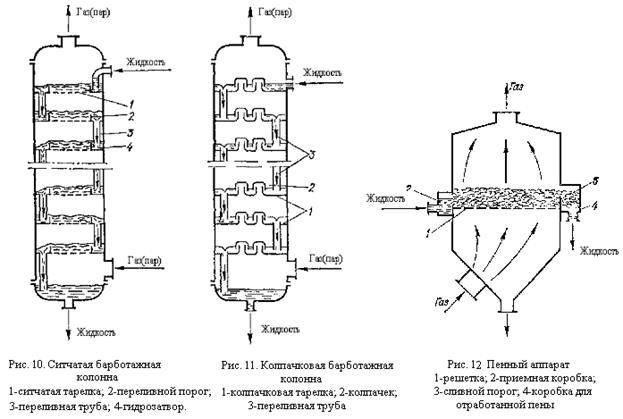
Способ увеличения поверхности контакта определяет конструкцию аппаратов к данной агрегатной системе. Во всех случаях стараются увеличить поверхность более тяжелой фазы— твердой в системах Г — Т, Ж — Т и жидкой в системе Г — Ж, так как более легкая фаза во всех типах аппаратов обмывает поверхность тяжелой фазы. Поверхность жидкой фазы увеличивают разделением жидкости в виде тонкой пленки на поверхности разных насадок, которыми заполняют реакционный объем аппарата. Жидкость разбрызгивается по всему сечению башни, смачивает всю поверхность насадки и стекает противотоком к газу, который двигается снизу вверх, как, например, при производстве Н2S04 (рис. 9).
В качественасадки чаще всего применяют кольца из стали или керамики разных размеров иформ. Такие башни широко используют в производстве Н2S04, HNО3, HCl и других кислот, при переработке топлива, в органическом синтезе и др. В других случаях увеличение поверхности соприкосновения достигают пневматическим или механическим распылением жидкостей, или барботажем (пробулькиванием) газа через слой жидкостей в колоннах с ситчатыми или колпачковыми тарелками (рис. 11; рис. 12). Барботажные колонны работают интенсивнее, чем башни с насадкой, но в них создается большое гидравлическое сопротивление газовому потоку. Такие колонны с колпачковымим или с ситчатыми тарелками применяют при дистилляции, ректификации, абсорбции, адсорбции в других процессах.
Очень эффективным, простым и экономичным способом развития поверхности контакта реагирующих фаз считают создание «слоя подвижной пены» через который, пропускается газ снизу вверх через решетку в пенном аппарате (рис. 13). Интенсивным перемешиванием фаз маленькими пузырьками газа и беспрерывным обновлением поверхности жидкости устраняется диффузионное сопротивление и возрастает коэффициент массопередачи или теплопередачи.
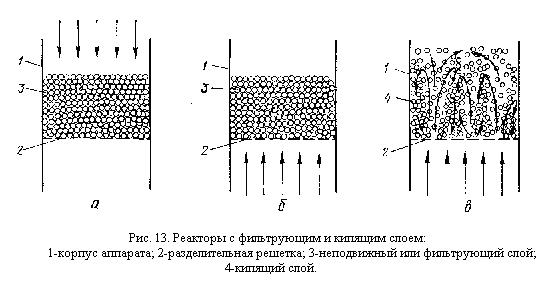
В системах Г — Т иЖ — Т большая площадь контакта фаз достигается раздроблением твердого материала или применением небольших и пористых кусков и гранул, в которых внутренняя поверхность пор может намного превышать внешнюю поверхность кусков. Примером является перемешивание тонко раздробленного твердого материала, при котором площадь контакта приближается к максимальной, в печах для обжига в кипящем слое, где каждая частичка твердого материала обмывается газом (рис. 13).
Колосниковые топки, ионообменные фильтры, шахтные печи, полочные контактные аппараты принадлежат к фильтрующим аппаратам, в которых газ или жидкость проходят через недвижимый слой кусков или гранул твердого материала. В них обмывается лишь та часть поверхности, которая не соприкасается с кусками или гранулами. Реакторы с фильтрующим слоем твердого зернистого материала просты, надежны в работе ипоэтому наиболее распространены в промышленности. Тем не менее, по интенсивности они уступают реакторам с кипящим слоем.
В системе двух несмешивающихся жидкостей,, также создается взвешенный слой тяжелой жидкости как слой подвижной эмульсии, подобный подвижной пене. Для увеличения поверхности контакта несмешивающихся жидкостей, применяют механические или пневматические мешалки, а для увеличения иобновления поверхности контакта в системах Т — Т. Ж Т, Г — Ж применяют, кроме того, вращающиеся барабаны.
Катализаторы.
Применение катализаторов повышает константу скорости реакции, не вызывая изменения движущей силы процесса.
Катализаторы ускоряют химические реакции вследствие замены одностадийного процесса, который требует большей энергии активации Е, на двух или более стадийный процесс, в каждой последовательной стадии которого нужна меньшая энергия активации.
Рассмотрим энергетическую картину реакционной системы, например для бимолекулярной реакции
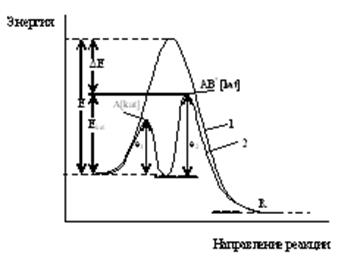
Изменение энергии реагирующей системы при некаталитической (1) и каталитической (2) реакции
Е – энергия активации некаталитической реакции;
Екат – каталитической реакции;
е1 и е2 – энергии активации промежуточных стадий.
проходящей в отсутствии катализатора по схеме:
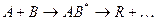
через образование активного комплекса АВ*. В присутствии катализатора реакция идет по другому пути через несколько элементарных стадий:
А + [kat] = A[kat]
A[kat] + B = AB*[kat]
AB*[kat] = R + [kat]...
Поскольку катализаторы не ускоряют диффузионные процессы, их можно применять лишь для процессов которые идут в кинетической области.
Перемешивание – увеличивает константу скорости процесса вследствие замены молекулярной диффузии на конвективную, т.е. снижение диффузионных сопротивлений, которые препятствуют взаимодействию компонентов. Итак, усиливать перемешивание нужно до тех пор, пока процесс из диффузионной области не перейдет в кинетическую.
В гомогенных процессах перемешивания выравнивает концентрацию в реакционном объеме, усиливает и увеличивает число столкновений реагирующих молекул. В гетерогенных системах перемешивание заменяет медленную молекулярную диффузию, которой определяется суммарная скорость процесса, на более быструю конвективную. Кроме того, перемешивание увеличивает поверхность взаимодействующих фаз, вследствие чего ускоряется перенос реагирующих компонентов и ускоряется реакция.
Увеличение движущей силы процесса может достигаться:
1. Увеличением концентрации взаимодействующих компонентов в исходных материалах (сырье).
2. Увеличение давления.
3. Отводом продуктов реакции из реакционного объема.
4. Сдвигом равновесия при изменении температуры и давления.
1. Увеличении концентрации взаимодействующих компонентов в исходном сырье повышает С и пропорционально скорость процесса. Способ увеличения концентрации взаимодействующих компонентов в исходном сырье зависит от агрегатного состояния материала. Увеличение содержания полезного составляющего в твердом сырье – называется обогащением, а в жидким и газообразном – концентрированием.
2. Повышение давления – влияет на скорость процесса (скорость достижения равновесного состояния обратимых процессов) и состояние равновесия.
Эффективность повышения давления зависит от агрегатного состояния реагирующих веществ.
Наиболее сильно давление влияет на процессы, которые идут в газовой фазе или же при взаимодействии газов с жидкостями твердыми телами. В меньшей степени давление сказывается на процессах идущих в жидкой или твердой фазах.
Повышение давления уменьшает объем газовой фазы и соответственно увеличивает концентрации взаимодействующих веществ. Таким образом, повышение давления это то же самое, что и увеличение концентрации реагентов.
Влияние давления определяется кинетическими уравнениями.
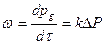
где  - парциальное давление компонента в газовой фазе.
- парциальное давление компонента в газовой фазе.
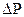 - движущая сила процесса.
- движущая сила процесса.
Для реакции:

если она необратимая или протекает вдали от состояния равновесия.
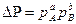
Парциальные давления каждого компонента пропорциональны общему давлению Р. При общем давлении смеси Р и доле в ней компонентов А и В m и n соответственно парциальные давления их:
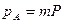
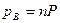
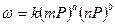
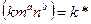
Уравнение скорости процесса:
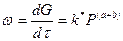
a+b=n - порядок реакции.
Итак, скорость газовой реакции пропорциональная общему давлению смеси в степени, равной порядку реакции.
Рис. 14 Влияние давления на скорость газовых реакций разного порядка
Для гетерогенных процессов адсорбции, абсорбции концентраций и других процессов перехода газового компонента в твердую или жидкую фазу:
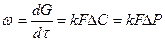
Если процесс обратим и далек от равновесия то:
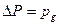
Где  - действительная концентрация компонента в газовой фазе, итак, порядок реакции n=1 и преобразовав формулу:
- действительная концентрация компонента в газовой фазе, итак, порядок реакции n=1 и преобразовав формулу:
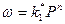 получим
получим 
т.е. скорость этих процессов прямо пропорциональная давлению. Поэтому в промышленности широко применяют повышение давления для ускорения абсорбции и увеличения концентрации компонента в жидкости соответственно закону распределения.
Для обратимых газовых реакций, которые протекают вблизи от состояния равновесия, движущая сила реакции выразится формулой:

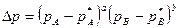
Зависимость от давления константы равновесия выраженной в молярных частицах определяют по уравнению:
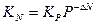
где 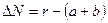
Формула ΔN- выражает количественно принцип Ле -Шателье, с увеличением давления Р для реакций, которые идут с уменьшением объема (ΔN-величина отрицательная) константа равновесия увеличивается, а равновесные концентрации исходных компонентов уменьшаются (рА* и рв*).
Для обратимых газовых реакций, которые идут с увеличением объема, давление сказывается положительно вдали от состояния равновесия за счет роста действительных концентраций исходных реагентов рА и рВ. Однако при приближении к состоянию равновесия выход продукта проходит через максимум, а потом снижается.
Это вызвано уменьшением КN и соответствующим увеличением равновесных концентраций исходных компонентов (рА* и рв*) в формуле:
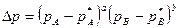
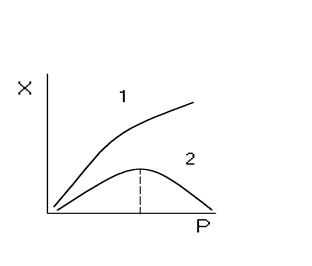
Рис. 8 Зависимость выхода продукта от давления для обратимой газовой реакции
τ, t, СА, и СВ = сonst
1- ΔN< 0 2 - ΔN> 0
 Отвод продуктов из реакционной зоны
Отвод продуктов из реакционной зоны
Суммарная скорость обратимой реакции 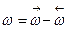
увеличивается за счет уменьшения  или увеличивает движущую силу гетерогенного процесса
или увеличивает движущую силу гетерогенного процесса 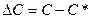 за счет снижения величины С*.
за счет снижения величины С*.
Если реакция идет в газовой фазе, то отвод продукта в жидкую фазу означает уменьшение С *вплоть до нуля. Из газовой фазы продукт реакции может отводиться, конденсацией, избирательной абсорбцией или адсорбцией.
Для этого газовую смесь выводят из реакционного аппарата, а потом после отделения продукта (конденсация абсорбция) снова вводят в аппарат – получаются замкнутые (циклические круговые процессы) например синтез аммиака.
В этом случае реакция в газовой фазе проходит стадиями. В каждой стадии концентрация продукта С*возрастает до максимально допустимой величины, а потом снижается почти до нуля при абсорбции, такой цикл может повторятся многократно.
Из жидкой смеси продукт реакции в зависимости от его свойств может отводиться осаждением в виде кристаллов, испарением в виде пара, или адсорбции твердым поглотителем.
Осаждение в виде кристаллов с последующим возвращением маточного раствора в процесс, широкого применяется в технологи минеральных солей (сульфат аммония, хлорид калия).
При адсорбции продукта на твердом поглотителе после его насыщения он извлекается из реактора и регенерируется путем нагревания или методом экстракции.
 2015-07-14
2015-07-14 9865
9865