Приступая к проектированию химического реактора, в котором должна проводиться, определенная химическая реакция необходимо ответить, на следующие вопросы:
1) Какой максимальный выход может быть получен в условиях принятых для проведения реакции?
2) Как быстро можно достичь этого максимального выхода?
С помощью термодинамических расчетов основанных, прежде всего на определении изменения энергии Гиббса ∆G можно установить или будет реакция в заданных условиях протекать самопроизвольно или нет. Константа равновесия химической реакции связанная с ∆G дает возможность рассчитать выход, который имеет решающее значение в определении возможности использования этой реакции в технических целях. Можно провести много примеров реакций, состояние равновесия которых указывает на возможность получения в определенных условиях почти полного превращения исходных веществ в продукты, но практически исходные вещества могут не реагировать даже после продолжительного периода проведения процесса.
Скорость химической реакции определяется как скорость изменения числа молей произвольно выбранного реагента в реакционной системе и определяется как:
w =- 
 (21)
(21)
Здесь Nи – число молей компонента и исходных веществ, которые находятся в реакционной системе объемом V в момент времени τ
В неоднородных системах, когда реакция проходит на границе раздела фаз, например жидкость - твердое тело скорость реакции часто относят к единице площади межфазной поверхности:
w =- 
 (22)
(22)
где S- площадь межфазной поверхности в реакционной системе.
Для реакции в газовой фазе в присутствии твердого катализатора удобно выражать скорость реакции в расчете на единицу массы твёрдой фазы:
w =- 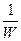
 (23)
(23)
где W- масса твердой фазы (катализатора).
В связи с уменьшением числа молей исходного вещества в результате реакции производная имеет отрицательное значение. Поэтому в правой части выражений ставят знак «-» необходимый, для того чтобы скорость реакции имела положительную величину.
 2015-07-14
2015-07-14 1141
1141
