Ко времени создания теории Бора об атоме водорода имелись следующие экспериментальные сведения. Атом водорода состоит из ядра (протона), несущего положительный заряд, равный по величине заряду электрона, и одного электрона, который согласно планетарной модели Резерфорда, движется вокруг ядра по круговой или эллиптической орбите. Размеры атома водорода определяются диаметром орбиты электрона и составляют несколько больше 10-10 м.
Ядерная модель атома в сочетании с классической механикой и электродинамикой оказалась неспособной объяснить ни устойчивость атома, ни характер атомного спектра. Выход из создавшегося тупика был найден в 1913 г. датским физиком Нильсом Бором, правда, ценой введения предположений, противоречащих классическим представлениям. Допущения, сделанные Бором, содержатся в двух высказанных им постулатах.
Первый постулат Бора (постулат стационарных состояний) гласит:
из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются в действительности только некоторые дискретные орбиты, удовлетворяющие определенным квантовым условиям. Электрон, находящийся на одной из этих орбит, несмотря на то, что он движется с ускорением, не излучает электромагнитных волн (света).
Согласно первому постулату атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию. Стационарным состояниям соответствуют стационарные орбиты, по которым электрон может вращаться вокруг ядра неопределенно долго, не излучая энергию. Энергия атома может измениться лишь при скачкообразном переходе электрона из одного энергетического состояния в другое.
Второй постулат Бора ( правило частот ) формулируется следующим образом: излучение испускается или поглощается в виде светового кванта энергии 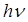 при переходе электрона из одного стационарного (устойчивого) состояния в другое (рис. 4.4). Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый переход электрона:
при переходе электрона из одного стационарного (устойчивого) состояния в другое (рис. 4.4). Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый переход электрона:
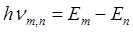 . (4.3)
. (4.3)
Отсюда следует, что изменение энергии атома, связанное с излучением при
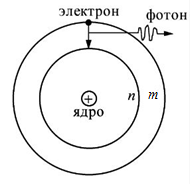
Рис. 4.4
поглощении фотона, пропорционально частоте ν:
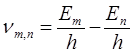 , (4.4)
, (4.4)
т.е. частота излучаемого света может быть представлена в виде разности двух величин, характеризующих энергию излучающей системы.
Второй постулат Бора также противоречит электродинамике Максвелла. По Бору частота излучения определяется только изменением энергии атома и никак не зависит от характера движения электрона. А согласно Максвеллу (т.е. с точки зрения классической электродинамики) частота излучения зависит от характера движения электрона. Согласно теории Бора энергия электрона в атоме водорода, находящегося на n-м энергетическом уровне, равна:
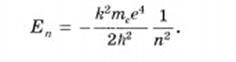 Важную роль в развитии планетарной модели сыграли эмпирические закономерности, полученные для линейчатого спектра атома водорода.
Важную роль в развитии планетарной модели сыграли эмпирические закономерности, полученные для линейчатого спектра атома водорода.
В 1858 г. швейцарский физик И. Бальмер установил, что частоты девяти линий в видимой области спектра водорода удовлетворяют соотношению
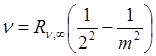 . (4.5)
. (4.5)
Здесь 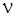 – частота световой волны,
– частота световой волны, 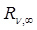 – постоянная, получившая название постоянной Ридберга, m =3,4, 5, …, 11.
– постоянная, получившая название постоянной Ридберга, m =3,4, 5, …, 11.
Открытие водородной серии Бальмера (4.5) послужило толчком для обнаружения других серий в спектре атома водорода в начале 20 века.
Из формулы (4.5) видно, что по мере увеличения m частота 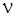 линий спектра возрастает, при этом интервалы между соседними частотами уменьшаются, так что при
линий спектра возрастает, при этом интервалы между соседними частотами уменьшаются, так что при 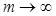 частота
частота 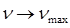 . Максимальное значение частоты в серии Бальмера, полученное при
. Максимальное значение частоты в серии Бальмера, полученное при 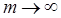 , называется границей серии Бальмера, за пределами которой находится непрерывный спектр.
, называется границей серии Бальмера, за пределами которой находится непрерывный спектр.
В ультрафиолетовой области спектра водорода находится серия Лаймана:
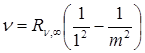 , m =2,3,4… (4.6)
, m =2,3,4… (4.6)
В инфракрасной области расположены еще четыре серии:
Серия Пашена, 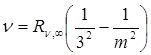 , m = 4,5,6…
, m = 4,5,6…
Серия Брэкета 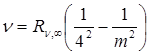 , m = 5,6,7… (4.7)
, m = 5,6,7… (4.7)
Серия Пфунда 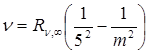 , m = 6,7,8…
, m = 6,7,8…
Серия Хэмфри 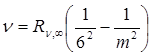 , m = 7,8,9…
, m = 7,8,9…
Как уже отмечалось, частоты всех линий спектра атома водорода представляются одной формулой (4.2).
Частота линии в каждой серии стремится к предельному (максимальному) значению 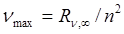 , которое называется границейсерии. Спектральные серии Лаймана и Бальмера обособлены, остальные серии частично перекрываются. Например, границы (длины волн) первых трех серий (Лаймана, Бальмера, Пашена) соответственно равны 0,0912 мкм, 0,3648 мкм, 0, 8208 мкм (λ min = c / ν max).
, которое называется границейсерии. Спектральные серии Лаймана и Бальмера обособлены, остальные серии частично перекрываются. Например, границы (длины волн) первых трех серий (Лаймана, Бальмера, Пашена) соответственно равны 0,0912 мкм, 0,3648 мкм, 0, 8208 мкм (λ min = c / ν max).
Бором было введено правило квантования орбит, которое гласит: в стационарном состоянии атома электрон, двигаясь по круговой орбите радиуса r, должен иметь дискретные, т.е. квантованные, значения момента импульса, удовлетворяющие условию
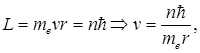 n =1, 2, 3…, (4.8)
n =1, 2, 3…, (4.8)
где n главное квантовое число.
Рассмотрим электрон (рис. 4.5), движущийся со скоростью V в поле атомного ядра с зарядом Ze. Квантовая система, состоящая из ядра и только одного электрона, называется водородноподобным атомом. Таким образом, термин «водородноподобный атом» применим, помимо атома водорода, у которого Z = 1, к однократно ионизированному атому гелия Hе +, к двукратно ионизированному атому лития Li +2 и т. д.
На электрон, движущийся по круговой стационарной орбите, действует электрическая, т.е. кулоновская сила притяжения со стороны ядра
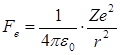 . (4.9)
. (4.9)
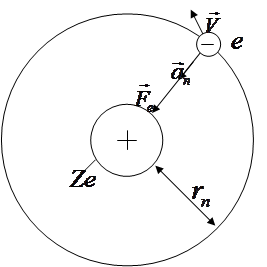
Рис. 4.5
В соответствии со вторым законом Ньютона запишем:
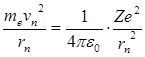 , (4.10)
, (4.10)
т.е. кулоновская сила притяжения компенсируется центробежной силой.
Подставив в формулу (4.10) выражение для скорости из (4.8) и решив полученное уравнение относительно rn, получим набор дискретных значений радиусов орбит электрона в водородоподобных атомах:
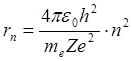 , (4.11)
, (4.11)
где n = 1,2,3….
С помощью формулы (4.11) определяют радиусы разрешенных стационарных орбит в боровской полуквантовой модели атома. Число n = 1 соответствует ближайшей к ядру орбите, поэтому для атома водорода (Z =1) радиус первой орбиты
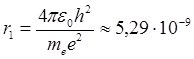 м, (4.12)
м, (4.12)
а соответствующая этой орбите скорость электрона
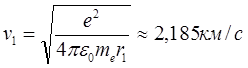 .
.
Наименьший радиус орбиты называется первым боровским радиусом
(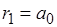 ). Из выражения (4.11) видно, что радиусы более далеких от ядра орбит для водородоподобных атомов увеличиваются пропорционально квадрату числа n (рис. 4.6)
). Из выражения (4.11) видно, что радиусы более далеких от ядра орбит для водородоподобных атомов увеличиваются пропорционально квадрату числа n (рис. 4.6)
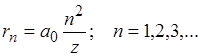 (4.13)
(4.13)
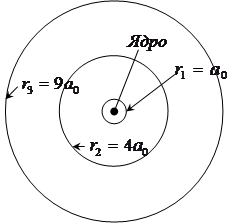
Рис. 4.6
Теперь рассчитаем для каждой из разрешенных орбит полную энергию электрона, которая состоит из его кинетической и потенциальной энергий:
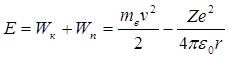 . (4.14)
. (4.14)
Напомним, что потенциальная энергия электрона в поле положительно заряженного ядра является величиной отрицательной. Подставляя в выражение (4.14) значение скорости v из (4.8), а затем, используя формулу (4.13) для r, получаем (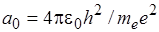 ):
):
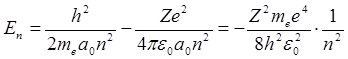 , n = 1, 2, 3 … (4.15)
, n = 1, 2, 3 … (4.15)
Отрицательный знак в выражении (4.15) для энергии атома обусловлен тем, что за нулевое значение потенциальной энергии электрона принято считать то, которое соответствует удалению электрона на бесконечность от ядра.
Орбита с самым малым радиусом соответствует наименьшему значению энергии и называется К - орбитой, за ней следует L - орбита, М – орбита и т.д. При движении электронов по этим орбитам атом находится в устойчивом состоянии.
Схема энергетических уровней для спектральных серий атома водорода, определяемых уравнением (4.15), изображена на рис. 4.7.
Горизонтальные линии соответствуют энергиям стационарных состояний.

Рис. 4.7
Расстояния между энергетическими уровнями пропорциональны квантам энергий, испускаемых атомом при соответствующих переходах электрона (изображены стрелками). При поглощении атомом квантов энергии направления стрелок следует изменить на противоположные.
Из выражения (4.14) видно, что в планетарной модели Бора энергетические состояния атома водорода характеризуются бесконечной последовательностью энергетических уровней En. Значения En обратно пропорциональны квадрату числа n, которое называется главным квантовым числом. Энергетическое состояние атома с n =1 называется основным или нормальным, т.е. невозбужденным состоянием, которое соответствует минимальному значению энергии. Если n > 1 состояние атома является возбужденным (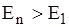 ).
).
Энергия E 1 основного состояния атома водорода из (4.15) равна│
– 13,53 эВ.
Энергия ионизации атома водорода,т.е. E i = │ E 1 - E∞ │= 13,53 эВ, равна работе, совершаемой при перемещении электрона из основного состояния (n =1) в бесконечность без сообщения ему кинетической энергии.
 2015-07-14
2015-07-14 16958
16958
