Алкины – это углеводороды, содержащие в своей структуре тройную связь. Общая формула ацетиленовых углеводородов СnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Н - С º С - Н
ацетилен
Номенклатура. По рациональной номенклатуре производные ацетилена рассматриваются как его замещенные, называются радикалы с прибавлением слова «ацетилен».
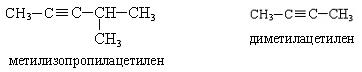
По систематической номенклатуре названия ацетиленовых углеводородов даются от соответствующих предельных углеводородов с заменой окончания на «-ин», нумерацию начинают с того конца, где ближе тройная связь:
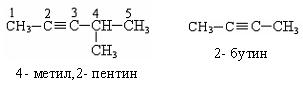
Способы получения. Существует несколько способов получения алкинов.
1. Электрокрекинг метана:
2СН4 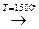 СН ≡ СН + 3Н2
СН ≡ СН + 3Н2
Реакцию проводят электродуговым способом, пропуская метан между электродами с временем контакта 0,1 – 0,01 секунды, чтобы ацетилен не разложился.
2. Синтез из углерода и водорода в вольтовой дуге:
2С + Н2 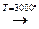 СН ≡ СН
СН ≡ СН
3. Окислительный крекинг метана:
4СН4 + 5О2 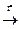 СН ≡ СН + СО + 7Н2О
СН ≡ СН + СО + 7Н2О
4. Синтез из карбида кальция (ацетиленида кальция):
СаС2 + 2Н2О → Са(ОН)2 + СН ≡ СН
Исходным веществом является СаСО3, разложением которого получается СаО, а затем карбид кальция:
а) СаСО3 → СаО + СО2
б) СаО+ 3С → СаС2 + СО
5. Синтез из альдегидов:
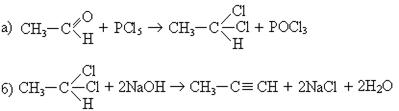
6. Синтез производных ацетилена через амид:
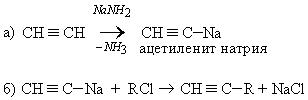
Химические свойства. Атомы углерода по тройной связивалкинах находятсяв состоянии sp-гибридизации и имеют две π-связи:
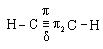
Типичными реакциями ацетиленовых углеводородов, к которым располагает электронная структура ацетилена, являются реакции электрофильного присоединения (АdЕ).
Другим направлением химически реакционной способности являются реакции нуклеофильного присоединения (АdN), возможность протекания которых объясняется большим вкладом s-орбитали в гибридное облако при sp-гибридизации, которое по форме приближается к сфере, а значит, электроны p-связи сильнее притягиваются ядром и не очень доступны для электрофильных частиц.
Кроме того, ацетиленовые углеводороды вступают в реакции замещения, окисления и полимеризации.
Реакции электрофильного присоединения (АdE).
1. Галогенирование:
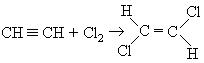
Реакция идет в транс-положение.
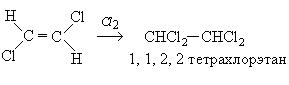
2. Гидрогалогенирование:
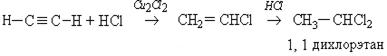
Гидрогалогенирование несимметричных производных ацетилена происходит в соответствии с правилом Морковникова:
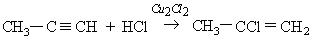
3. Гидрогенизация. В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов, а затем алканов:
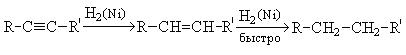
При использовании менее активного катализатора [Pd/CaCO3/Pb(CH3COO)2] гидрирование останавливается на стадии образования алкенов.
4. Гидратация (реакция Кучерова). Присоединение воды происходит в присутствии катализатора, соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид:
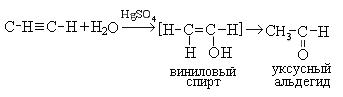
Процесс изомеризации находится в соответствии с правилом Эдьтекова, согласно которому структура гидроксила при двойной связи нестабильна и всегда изомеризуется в структуру, содержащую карбонильную группу. Этот переход называется еще кето-енольной таутометрией. При гидратации производных ацетилена образуются кетоны:
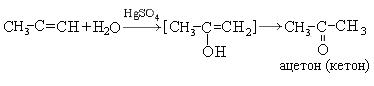
5. Реакция с карбоновыми кислотами:
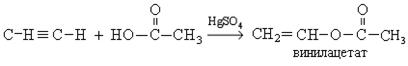
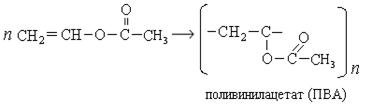
Поливинилацетат используется для изготовления водо-эмульсионных красок, клея, лака.
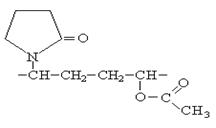
Сополимер винилацетата с винилпиролидоном является основным компонентом лака для волос.
Переэтерификация поливинилацетата метанолом позволяет получить поливиниловый спирт:
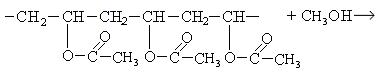
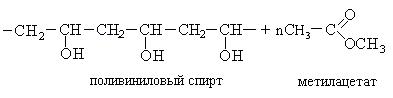
Используется поливиниловый спирт в больших количествах для повышения сохранности фруктов. Образующаяся пленка от поливинилового спирта легко растворяется в воде.
Реакции нуклеофильного присоединения (AdN):
1. Реакция со спиртами:
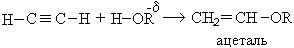
Механизм реакции:
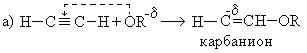
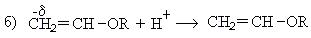
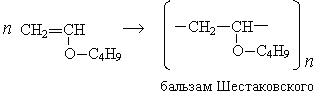
При взаимодействии ацетилена бутанолом получается винилбутиловый эфир, последующая полимеризация которого дает бальзам Шестаковского, используемый как лекарственное средство:
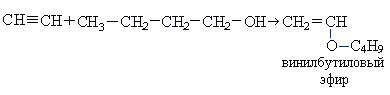
2. Взаимодействие с синильной кислотой:
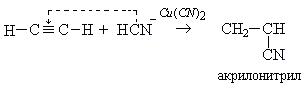
Полимеризацией акрилонитрила получают синтетическое волокно полиакрилонитрил (ПАН):
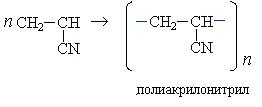
Реакции замещения (S). Атомы водорода в ацетиленовых углеводородах очень подвижны, то есть обладают определенной кислотностью и ацетилен диссоциирует по схеме:
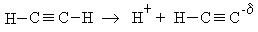
Проявление кислотных свойств ацетилена объясняется именно за счет особенностей sp-гибридизации, когда электроны π-связи сильно притягиваются ядрами атома углерода и атомы водорода практически не удерживаются ими. Кислотность ацетилена можно сравнить в следующих рядах:
1. Взаимодействие с натрием:
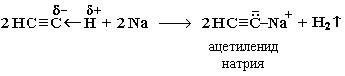
2. Взаимодействие с амидом натрия:
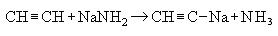
3. Взаимодействие ацетилена (или 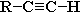 ) с аммиачными растворами оксида серебра или хлорида меди (I). При взаимодействии ацетилена с аммиачными растворами оксида серебра или хлорида меди выпадают осадки нерастворимых ацетиленидов:
) с аммиачными растворами оксида серебра или хлорида меди (I). При взаимодействии ацетилена с аммиачными растворами оксида серебра или хлорида меди выпадают осадки нерастворимых ацетиленидов:
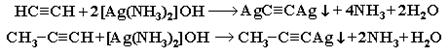
Образование белого осадка ацетиленида серебра (или красно-коричневого – ацетиленида меди 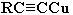 ) служит качественной реакцией на концевую тройную связь.
) служит качественной реакцией на концевую тройную связь.
Ацетилениды разлагаются при действии кислот:

В сухом состоянии ацетилениды тяжелых металлов чувствительны к ударам и легко взрываются.
Если тройная связь находится не на конце цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются:
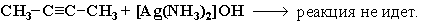
 2015-03-20
2015-03-20 10977
10977








