I. Основные оксиды
1. Большинство основных оксидов не распадается при нагревании, исключение составляют оксиды ртути и благородных металлов.
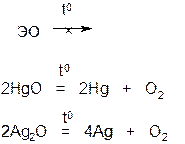
2. Основные оксиды при нагревании могут вступать в реакции с кислотами, с кислотными и амфотерными оксидами
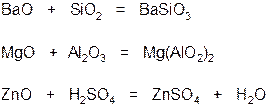
3. Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой
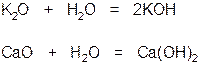
4. Оксиды могут вступать в окислительно-восстановительные реакции
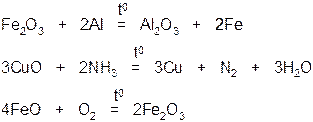
II. Кислотные оксиды. Это такие оксиды, которым соответствуют кислоты. Например: CO2, P2O5, SO2, SO3 – кислотные оксиды, так как им соответствуют кислоты H2CO3, H3PO4, H2SO3, H2SO4.
Кислотные оксиды могут быть получены аналогичными методами получения основных оксидов.
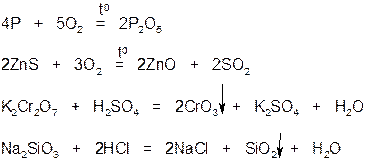
Большинство кислотных оксидов непосредственно взаимодействуют с водой с образованием кислот.
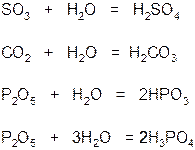
Химические свойства.
1. Вступают в реакции с основными и амфотерными оксидами и щелочами.
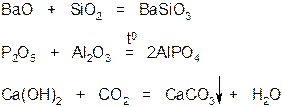
2. Вступают в окислительно-восстановительные реакции.
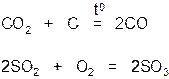
III. Амфотерные оксиды – такие оксиды, которые в зависимости от условий проявляют основные или кислотные свойства, то есть обладают двойственными свойствами. Например: ZnO, Al2O3, Cr2O7, BeO, Fe2O3.
Амфотерные оксиды с водой непосредственно не соединяются, но они реагируют с кислотами и основаниями.
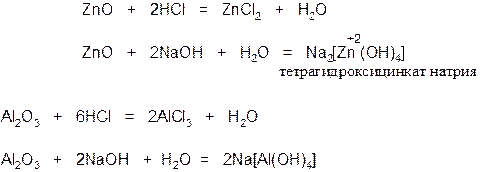
Идеально амфотерным оксидом является вода, которая диссоциирует с образованием одинаковых количеств ионов водорода (кислотные свойства) и гидроксид-иона (основные свойства). Амфотерные свойства воды ярко проявляются при гидролизе растворённых в ней солей.
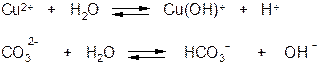
 2015-07-14
2015-07-14 628
628








