 В две пробирки внес по 3-5 капель раствора соли цинка и несколько капель раствора едкого натра до образования осадка гидроксида цинка. Растворил полученные осадки в одной пробирке в растворе соляной кислоты, в другую – в избытке раствора едкого натра. Получил:
В две пробирки внес по 3-5 капель раствора соли цинка и несколько капель раствора едкого натра до образования осадка гидроксида цинка. Растворил полученные осадки в одной пробирке в растворе соляной кислоты, в другую – в избытке раствора едкого натра. Получил:
 А. 1. ZnSO4 + 2NaOH = Na2SO4 +Zn (OH)2
А. 1. ZnSO4 + 2NaOH = Na2SO4 +Zn (OH)2
Zn2+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + Zn (OH)2
 Zn2++2OH- = Zn (OH)2
Zn2++2OH- = Zn (OH)2
Zn (OH)2 + 2HCl = ZnCl2 + 2H2O
Zn (OH)2+ 2H+ + 2Cl- = Zn2+ + 2Cl- + 2H2O
Zn (OH)2+ 2H+ = Zn2+ + 2H2O 
 |
2. ZnSO4 + 2NaOH = Na2SO4 +Zn (OH)2
Zn2+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + Zn (OH)2
 Zn2+ + 2OH- = Zn (OH)2
Zn2+ + 2OH- = Zn (OH)2
Zn (OH)2 + 4NaOH = Na4[Zn(OH)6]
Zn(OH)2 + 4Na+ + 4OH- = 4Na+ + Zn(OH)64-
Zn(OH)2 + 4OH- = Zn(OH)64-
Для образования осадка мы добавили в сульфат цинка 5 капель гидроксида натрия. Полученный осадок растворяется в кислоте хорошо. Для того чтобы полученный осадок растворился в щелочи понадобилось добавить 35 капель, полученный гидроксид металла плохо растворялся в щелочи.
 Б.1. Al2(SO4)3 +6NaOH = 2Al(OH)3 + 3Na2SO4
Б.1. Al2(SO4)3 +6NaOH = 2Al(OH)3 + 3Na2SO4
2Al+3 + 3SO42- + 6Na+ + 6OH- = 6Na+ + 3SO42- + 2Al (OH)3
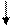 Al+3 + 3OH- = Al (OH)3
Al+3 + 3OH- = Al (OH)3
2Al (OH)3 + 6HCl =2AlCl3 + 6H2O
Al (OH)3 + 6H+ + 6Cl- = 2Al+3 + 6Cl- + 6H2O
Al (OH)3 + 6H+ = Al+3 + 6H2O 
 2. Al2(SO4)3 +6NaOH = 2Al(OH)3 + 3Na2SO4
2. Al2(SO4)3 +6NaOH = 2Al(OH)3 + 3Na2SO4
2Al+3 + 3SO42- + 6Na+ + 6OH- = 6Na+ + 3SO42- + 2Al (OH)3
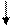 Al+3 + 3OH- = Al (OH)3
Al+3 + 3OH- = Al (OH)3
Al(OH)3+ NaOH = Na[Al(OH)4]
Al(OH)3 + Na+ + OH- = Na+ + Al(OH)-
Al(OH)3 + OH- = Al(OH)4-
 Для получения осадка мы добавили к сульфату алюминия 5 капель гидроксида натрия. Полученный осадок хорошо растворяется в кислоте. Для того, чтобы полученный осадок растворился в щелочи нам пришлось добавить 18 капель щелочи, полученный осадок растворялся в щелочи и кислоте значительно лучше чем в прошлом опыте.
Для получения осадка мы добавили к сульфату алюминия 5 капель гидроксида натрия. Полученный осадок хорошо растворяется в кислоте. Для того, чтобы полученный осадок растворился в щелочи нам пришлось добавить 18 капель щелочи, полученный осадок растворялся в щелочи и кислоте значительно лучше чем в прошлом опыте.
В. 1 . Cr2 (SO4)3 + 6NaOH = 3Na2SO4 +2Cr (OH)3
 2Cr3+ +3SO42- + 6Na+ + 6OH- = 6Na+ + 3SO42- + Cr (OH)3
2Cr3+ +3SO42- + 6Na+ + 6OH- = 6Na+ + 3SO42- + Cr (OH)3
2Cr3+ + 6OH- = Cr (OH)3
2Cr(OH)3 +6 HCl =2CrCl3 + 6H2O
2Cr (OH)3 + 6H+ + 6Cl- = 2Cr+3 + 6Cl- + 6H2O
2Cr (OH)3 + 6H+ = Al+3 + 6H2O 
 |
2. Cr2 (SO4)3 + 6NaOH = 3Na2SO4 +2Cr (OH)3
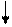 2Cr3+ +3SO42- + 6Na+ + 6OH- = 6Na+ + 3SO42- + Cr (OH)3
2Cr3+ +3SO42- + 6Na+ + 6OH- = 6Na+ + 3SO42- + Cr (OH)3
2Cr3+ + 6OH- = Cr (OH)3
Cr(OH)3+ NaOH = NaCrO2 +2 H2O
Cr(OH)3 + Na+ + OH- = Na+ + CrO2- + 2 H2O
Cr(OH)3 + OH- = CrO2- +2 H2O
Для того чтобы получить осадок нам пришлось добавить 5 капель гидроксидда натрия к сульфату хрома(3). Полученный осадок хорошо растворялся в кислоте. Для того чтобы растворить полученный гидроксид металла нам пришлось добавить 15 капель щелочи. Полученный осадок растворялся в кислоте и щелочи намного лучше чем в предыдущих опятах.
Вывод: Проводя данные опыты, я обнаружил, что полученные гидроксиды реагируют как с кислотами так и с основаниями. Такие гидроксиды называются амфотерными. Из полученных гидроксидов металлов более основными свойствами обладает гидроксид цинка, а более кислыми гидроксид хрома(3). На основе полученных данных я расположил гидроксиды в порядке увеличения их кислотности:Zn (OH)2; Al(OH)3; Cr(OH)3.
 2015-07-21
2015-07-21 8825
8825








