Лабораторная работа №8
Часть 1. Титрование перманганатом (перманганатометрия).
Перманганат-ион MnO4- в сильнокислых растворах окисляет многие вещества, восстанавливаясь при этом до иона двухвалентного марганца:
MnO-4 + 8Н+ + 5е = Mn2+ + 4Н2О
В связи с высоким значением восстановительного потенциала (φ0 = 1,551 В) его можно применять для титрования почти всех веществ, способных окисляться.
Основным условием титрования перманганатом является высокая кислотность среды; количество кислоты, необходимое для определения, нельзя рассчитывать по уравнению реакции. Необходимо, чтобы раствор был приблизительно 1н по кислоте, иначе в конце титрования, вследствие расхода кислоты на реакцию, концентрация водородных ионов сильно уменьшается, что приводит к понижению потенциала, а также к протеканию побочного процесса выделения осадка MnO2.
Чаще всего для подкисления применяют серную кислоту. Соляная кислота менее пригодна для этой цели, т.к. при этом возможно окисление ионов хлора перманганатом или различными промежуточными оксидами.
|
|
|
Азотная кислота сама является сильным окислителем и может вызвать побочные процессы.
При титровании перманганатом обычно не применяют индикатор, т.к. собственная окраска раствора реагента достаточно интенсивна. Точку конца титрования устанавливают по появлению окраски при добавлении одной избыточной капли титранта к аликвоте исследуемого раствора.
Особенности реактива
Марганцевокислый калий не обладает абсолютно свойствами исходного вещества, соль часто содержит незначительные количества различных примесей, главной из которых является MnO2. Концентрация растворов KMnO4 некоторое время после приготовления медленно изменяется вследствие ряда причин. Вследствие этого раствор KMnO4 точно заданной концентрации не готовят непосредственно по точной навеске вещества; нормальную концентрацию устанавливают по какому-либо другому веществу – вторичному стандарту.
Хранят растворы KMnO4 в темной стеклянной посуде, защищенной от попадания пыли.
Определение пероксида водорода
Качество препарата пероксида водорода определяется массовой долей Н2О2. Со временем пероксид водорода частично разлагается с выделением кислорода:
Н2О2 → Н2О + ½ О2
Этот процесс особенно заметен, если хранить пероксид водорода на свету, а не в защищенном от света месте.
Для проверки качества реактива определяют ω (Н2О2) в препарате.
Сущность метода
Пероксид водорода Н2О2 обладает одновременно свойствами окислителя и восстановителя, т.к. степень окисления атома кислорода в Н2О2 является промежуточной между степенью его окисления в Н2О и О2.
|
|
|
Когда Н2О2 является окислителем, то его восстановление характеризуется полуреакцией:
Н2О2 + 2е + 2Н+ = 2Н2О
Действуя в качестве восстановителя, Н2О2 окисляется с выделением кислорода:
Н2О2 – 2е → О2 + 2Н+
Перманганатометрическое определение пероксида водорода состоит в окислении его до свободного кислорода:
2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 5O2 + 8H2O
или:
2КМnО4 + 5Н2О2 + 3Н2SO4 = 2МnSO4 + 5O2 + 8Н2О
В точке эквивалентности:
ν (1/5 KMO4) = ν (1/2 H2O2)
Порядок выполнения работы:
1. Получают задачу у преподавателя, разбавляют водой до метки, тщательно перемешивают. Записывают в тетрадь объем мерной колбы (V м.к.). Плотность раствора 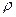 считать равной 1 г/мл.
считать равной 1 г/мл.
2. Предварительно вымытую и промытую стандартным раствором бюретку со стеклянным наконечником заполненную раствором титранта КMnО4, устраняют из носика пузырьки воздуха, доводят до нулевой метки. Записывают в тетрадь нормальную концентрацию раствора титранта.
3. Предварительно вымытой и промытой исследуемым раствором пипеткой отбирают аликвоту анализируемого раствора Н2О2, переносят раствор в тщательно промытую водой коническую колбу для титрования, приливают к раствору 10-15 мл H2SO4 (1:4) и содержимое колбы титруют рабочим раствором KMnO4 до появления розового неисчезающего окрашивания от одной избыточной капли раствора KMnO4. Титрование повторяют три раза.
Примечание:
Первые капли раствора KMnO4 обесцвечиваются очень медленно, а затем по мере увеличения количества Mn2+ (катализатор) реакция идет значительно быстрее.
Полученные результаты заносят в таблицу 1.
Таблица 1
 2015-07-21
2015-07-21 433
433







