Для очистки сточных вод используют следующие окислители: газообразный и сжиженный хлор, диоксид хлора, хлорат кальция, гипохлориты кальция и натрия, перманганат калия, бихромат калия, пероксид водорода, кислород воздуха, пероксосерные кислоты, озон, пиролюзит и др.
В процессе окисления токсичные загрязнения, содержащиеся в сточных водах, в результате химических реакций переходят в менее токсичные, которые удаляют из воды. Очистка окислителями связана с большим расходом реагентов, поэтому ее применяют только в тех случаях, когда вещества, загрязняющие сточные воды, нецелесообразно, или нельзя извлечь другими способами. Например, очистка от цианидов, растворенных соединений мышьяка и др.
Активность вещества как окислителя определяется величиной окислительного потенциала. Из всех известных в природе окислителей первое место занимает фтор, который, однако, из-за высокой агрессивности не может быть использован на практике. Для других веществ величина окислительного потенциала равна: для озона — 2,07; для хлора — 0,94; для пероксида водорода — 0,68; для перманганата калия — 0,59.
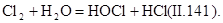 |
Окисление хлором. Хлор и вещества, содержащие «активный» хлор, являются наиболее распространенными окислителями. Их используют для очистки сточных вод от сероводорода, гидросульфида, метилсернистых соединений, фенолов, цианидов и др. При введении хлора в воду образуются хлорноватистая [оксохлорат(I) водорода] и соляная (хлороводородная) кислоты:
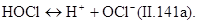 |
Далее происходит диссоциация хлорноватистой кислоты, степень которой зависит от рН среды. При рН=4 молекулярный хлор практически отсутствует:
Сумма С1 2+ НОС1+ОС1 - называется свободным «активным» хлором.
В присутствии аммонийных соединений в воде образуется хлорноватистая кислота, хлорамин NH 2 Cl и дихлорамин NHCl 2. Хлор в виде хлорамина называется связанным «активным» хлором.
Процесс хлорирования проводят в хлораторах периодического и непрерывного действия, напорных и вакуумных. Принципиальная схема очистки вод хлорированием показана на рис. II-59. Хлорирование проводится в емкости, включенной в систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода выводится для использования.
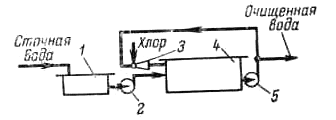
Рис. 11-59. Схема установки для очистки воды хлорированием:
1 — усреднитель; 2,5 — насосы; 3 — инжектор; 4 — емкость
При обезвреживании вод от цианидов процесс проводят в щелочной среде (рН=9). Цианиды можно окислить до элементного азота и диоксида углерода по уравнениям
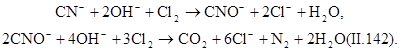
Источниками «активного» хлора могут быть также хлорат кальция, гипохлориты, хлораты, диоксид хлора. Хлорат кальция (хлорную известь) получают при взаимодействии
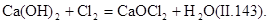 |
Гипохлорит (оксохлорат) натрия образуется при пропускании газообразного хлора через раствор щелочи:
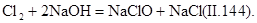 |
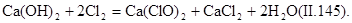 |
Гипохлорит кальция приготовляют хлорированием гидроксида кальция при температуре 25—30°С:
Промышленность выпускает двухосновную соль Са(Сl 2)•2Са(ОН) 2 •2Н 2 0.
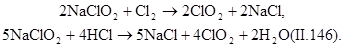 |
Сильным окислителем является хлорат натрия NaClO 2, который разлагается с выделением ClO 2. Диоксид хлора зеленовато-желтый ядовитый газ, обладающий более интенсивным запахом, чем хлор. Для его получения проводят следующие реакции:
При окислении цианидов «активным» хлором процесс можно проводить в одну ступень до получения цианатов:
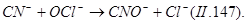 |
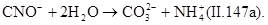 |
Окисление цианидов до цианатов происходит за счет атомного кислорода в момент его выделения из окислителя. Образовавшиеся цианаты легко гидролизуются до карбонатов:
Скорость гидролиза зависит от рН среды. При рН=5,3 за сутки гидролизуется около 80% цианатов. В двухступенчатом процессе цианиды окисляются до N 2 и СО 2. На первой ступени процесс протекает по реакции (II.147). На второй ступени вводят дополнительное количество окислителя и реакция протекает по уравнению
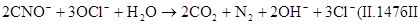
Во время реакций рН поддерживают в пределах 8—11. Контроль полноты окисления производят по остаточному «активному» хлору, концентрация которого должна быть не менее 5— 10 мг/л.
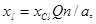 |
Товарный хлорат кальция содержит до 33% «активного» хлора, а гипохлорит кальция — до 60%. Потребность реагентов хl (в кг/сут) для окисления подсчитывается по формуле

где XCl — расход «активного» хлора, необходимого для окисления цианидов, кг/м3; Q — расход воды, м3/сут; n — коэффициент избытка реагента (n=1,2—1,3); а — содержание «активного» хлора в реагенте, в долях единицы.
Окисление пероксидом водорода. Пероксид водорода является бесцветной жидкостью, в любых соотношениях смешивается с водой. Она может быть использована для окисления нитритов, альдегидов, фенолов, цианидов, серосодержащих отходов, активных красителей. Промышленность выпускает 85—95%-ный пероксид водорода и пергидроль, содержащий 30% Н 2 О 2. Пероксид водорода токсичен. ПДК в воде составляет 0,1 мг/л.
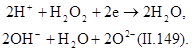 |
Пероксид водорода в кислой и щелочной средах разлагается по следующим схемам:
В кислой среде более отчетливо выражена окислительная функция, а в щелочной — восстановительная.
В кислой среде пероксид водорода переводит соли двухвалентного железа в соли трехвалентного, азотистую кислоту — в азотную, сульфиды — в сульфаты. Цианиды в цианаты окисляются в щелочной среде (рН=9—12).
В разбавленных растворах процесс окисления органических веществ протекает медленно, поэтому используют катализаторы — ионы металлов переменной валентности (Fe2+, Си2+, Mg2+, Co2+ Сr2+, Ag+). Например, процесс окисления пероксидом водорода с солью железа протекает весьма эффективно при: рН=3—4,5. Продуктами окисления являются муконовая и малеиновая кислоты.
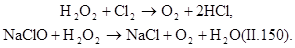 |
В процессах водообработки используют не только окислительные, но и восстановительные свойства пероксида водорода. В нейтральной и слабощелочной средах он легко взаимодействует с хлором и гипохлоритами, переводя их в хлориды:
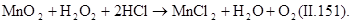 |
Эти реакции используют при дехлорировании воды. Избыток пероксида водорода можно удалять, обрабатывая его диоксидом марганца:
Перспективным является окисление загрязнений пероксосерными кислотами: пероксомоносерной Н 2 SO 5 и пероксодисерной Н 2 S 2 O 8. Например, фенол окисляется пероксомоносерной кислотой (кислота Каро) при рН=10. Этим методом возможно снизить содержание фенола до 5*10-6%). Скорость окисления зависит от соотношения Н 2 SO 5 /С 6 Н 5 OH и повышается с ростом температуры.
Разрушение цианидов под действием пероксосерных кислот протекает также очень быстро. При этом в случае небольших концентраций цианидов (0,01—0,05%) в сточной воде используют Н 2 SО 5, а при высоких концентрациях — Н 2 S 2 O 8. Оптимальным условиям соответствует рН=9. В нейтральной среде реакция окисления резко замедляется под действием ионов железа, которые образуют ферроцианы, не подвергающиеся окислению.
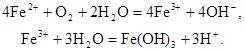 |
Окисление кислородом воздуха. Кислород воздуха используют при очистке воды от железа для окисления соединений двухвалентного железа в трехвалентное с последующим отделением от воды гидроксида железа. Реакция окисления в водном растворе протекает по схеме
Окисление проводят при аэрировании воздуха через сточную воду в башнях с хордовой насадкой. Образующийся гидроксид железа отстаивают в контактном резервуаре, а затем отфильтровывают. Использование колонн с кусковой насадкой или кольцами Рашига нецелесообразно, так как происходит зарастание насадки. Возможен процесс упрощенной аэрации. В этом случае над поверхностью фильтра разбрызгивают воду, которая в виде капель падает на поверхность фильтрующей загрузки. При контакте капель воды с воздухом происходит окисление железа.
Кислородом воздуха окисляют также сульфидные стоки целлюлозных, нефтеперерабатывающих и нефтехимических заводов. Процесс окисления гидросульфидной и сульфидной серы протекает через ряд стадий при изменении валентности серы с -2 до +6:
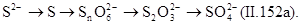 |
При этом при окислении гидросульфида и сульфида до тиосульфата рН раствора повышается, при окислении гидросульфида до сульфида и сульфата рН раствора понижается, а при окислении сульфида до сульфита и сульфата активная реакция среды не изменяется.
С повышением температуры и давления скорость реакции и глубина окисления сульфидов и гидросульфидов увеличивается. Теоретически на окисление 1 г сульфидной серы расходуется
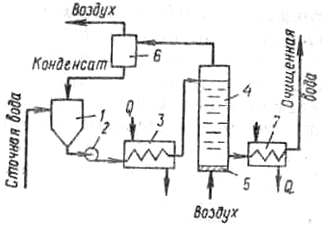
Рис. 11-60. Схема установки окисления сульфидов:
1 — приемный резервуар; 2 — насос; 3 — теплообменник; 4 — окислительная колонна; 5 — воздухораспределительное устройство; 6 — сепаратор; 7 — холодильник
1 г кислорода. Принципиальная схема установки окисления сульфидов приведена на тис. II-60.
 2015-08-21
2015-08-21 2595
2595
