Вариант тестового задания по теме «Основные химические законы. Строение вещества»
| Задание №1 Молярная масса эквивалента KMnO4, восстановленного до MnO2.составляет: | Варианты ответа а) 52,6 г б) 31,6 г в) 158 г г) 48,6 г |
| Задание №2 Какому иону соответствует формула: 1S22S22P63S23P63d104S2 | Варианты ответа а)Zn2+б) Са2+в) As3+г) Se2- |
| Задание №3 Как меняется электроотрицательность в ряду: F, CI, Br, I? | Варианты ответа а) возрастает; б) убывает; в) периодически меняется; г) остается постоянной |
| Задание №4 У какого из перечисленных элементов наибольшее сродство к электрону? | Варианты ответа а) О; б) S; в) Se;г) Те |
| Задание №5 Энергия ионизации атомов в группе растет | Варианты ответа а) слева – направо; б) снизу вверх; в) от бора к астату; г) справа – налево |
| Задание №6 Атом, какого элемента имеет наибольший радиус? | Варианты ответа а) С; б) В; в) О; г) F |
| Задание №7 Формула высшего оксида элемента, образующего летучий гидрид состава ЭН3 | Варианты ответа а) ЭО; б) ЭО2; в) ЭО4; г)Э2О5 |
| Задание №8 При взаимодействии, какого элемента с кислородом образуется пероксид? | Варианты ответа а) Fe; б) Na; в) Li; г)Mg |
| Задание №9 Какие из ниже написанных оснований будут реагировать с едким натром? | Варианты ответа а)Zn(OH)2; б)Al(OH)3; в)Mg(OH)2; г)Fe(OH)2 |
| Задание №10 В каком из соединений образуется наиболее прочная химическая связь? | Варианты ответа а)LiF; б) LiCI; в) LiBr; г) LiI |
| Задание №11 Укажите вещества с преимущественно ионным типом связи: | Варианты ответа а)Na2O;б)H2O;в)HCl;г)H2 |
| Задание №12 Вещества, содержащие только ковалентные полярные связи | Варианты ответа а)H3PO4, BF3, CH3COONH4; б)H2SO4, F2, P2O5 в)PF5, Cl2O7, NH4Cl г)NO2, SOCl2, CH3COOH |
| Задание №13 Определите, каким кислотам принад- лежат приведённые ниже графические формулы: | а) 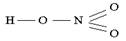 б) б) 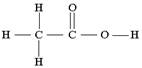 |
| Задание №14 Определите, графическая формула какой соли приведена, напишите ее химическую формулу: | 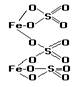 |
| Задание №15 Какие элементы, химические знаки кото- рых приведены ниже, способны к образо- ванию межмолекулярных водородных связей: | Варианты ответа а) Sе; б) C; в) O; г) Te, |
| Задание №16 Какой заряд имеет ион [Fe2+(NC)5OH2]? | Варианты ответа а) 3-; б) 2-; в) 3+; г) 2+ |
| Задание №17 Ртуть(II) нитрат при действии избытка калий иодида перейдет в: | Варианты ответа а)ртуть(I)иодид; б)ртуть(II) иодид; в) ртуть; г) калий тетраиодомеркурат(II) |
| Задание №18 Определить степень окисления и к.ч. комплексообразователя в NH4CI. | Варианты ответа a) +1,4; б) -3,1; в) -3,4; г) +1,1 |
| Задание №19 Какой комплексный ион образуется при взаимодействии двух солей CrCl3 + 3KCl: | Варианты ответа а) [KCl6]3-; б) [K3(CrCl6)]3+; в) [CrCl6]3-; г) [Cr(K3Cl)]3+ |
| Задание №20 При взаимодействии SO2с избытком едкого натра образуются: | Варианты ответа а) гидросульфит натрия; б) гидросульфат натрия; в) сульфит натрия и вода; г) сульфат натрия и вода. |
Вариант тестового задания по теме «Закономерности протекания химических процессов»
| Задание №1 ΔНореакции: CaO(к) + CO2(г) = CaCO3(к) составляет, кДж | Варианты ответа а) -177; б) -1,77; в) 177 г); -2237 |
| Задание №2 Стандартная энтальпия образования SO2 равна -297 кДж/моль. Чему равно количество тепла, выделившееся при сгорании 16 г серы: | Варианты ответа а) 74,25кДж; б) 148,5кДж; в) 297кДж; г) 594кДж |
| Задание №3 В изолированной системе реакция может протекать самопроизвольно, если: | Варианты ответа а) изменение энтропии системы положи- тельно; б)изменение энтропии системы от- рицательно; в) изменение энтальпии систе- мы положительно; г) изменение энергии Гиббса системы отрицательно |
| Задание №4 В открытой системе реакция может протекать самопроизвольно, если: | Варианты ответа а) изменение энтропии системы положи- тельно; б)изменение энтропии системы отрицательно; в) изменение энтальпии сис- темы положительно г) изменение энергии Гиббса системы отрицательно |
| Задание №5 Применение катализатора преследует: | Варианты ответа а) смещение равновесия; б) снижениеэнер- гии активации; в)снижение расхода реаген- тов; г)увеличение выхода продуктов |
| Задание №6 Как изменится скорость прямой реакции 2СО(г)+О2(г)↔2СО2(г), при увеличении концентрации [СО] в 3 раза? | Варианты ответа а) увеличится втрое; б) увеличится в 9 раз; в) не изменится; г) уменьшится в 3 раза |
| Задание №7 Как нужно изменить давление, чтобы увеличить скорость реакции получения аммиака в 16 раз? | Варианты ответа а) в 9 раз; б) в 2 раза; в) в 4 раза; г) не менять |
| Задание №8 Чему равен температурный коэффициент, если при охлаждении на 300С скорость реакции уменьшилась в 8 раз. | Варианты ответа а) 2; б) 3; в) 4; г) 8 |
| Задание №9 Температурный коэффициент γ=2. На сколько градусов нужно нагреть реакционную смесь для увеличения скорости реакции в 16 раз? | Варианты ответа а)на100С; б) на 300С; в) на 400С; г)на 200С |
| Задание №10 Куда сместится равновесие: PCl5(г)↔PCl3(г)+Cl2(г)при уменьшении темпера- туры, если прямая реакция является эндотермической? | Варианты ответа а) влево; б) вправо; в) не сместится; г) в сторону угла; |
| Задание №11 Какова процентная концентрация раствора, если в 200 г воды растворено 50 г вещества? | Варианты ответа а)25%; б)50%; в) 20%; г) 40% |
| Задание №12 Смешали 200 г 20%-ного и 300г 10%-ного растворов глюкозы. Концентрация полученного раствора будет: | Варианты ответа а) 15%; б) 18%; в) 16%; г) 14%. |
| Задание №13 рН раствора =6, [ОН-]=? | Варианты ответа а) 10-6; б) 10-8; в) 10 -4 ; г) 10-14 |
| Задание №14 Щелочным является раствор, у которого: | Варианты ответа а) pH = 7; б) [H+] = 10-9 моль/л; в)[OH-] = 10-9моль/л; г) pOH = 10 |
| Задание №15 Какая из указанных солей дает щелочную реакцию среды за счет гидролиза: | Варианты ответа а) Na2CO3; б) AlCl3; в) (NH4)2SO4; г)KNO3 |
| Задание №16 Растворимость BaCO3 равна 1,7·10-3 моль/л, рассчитать ПР BaCO3. | Варианты ответа а)2,89·10-6; б) 1,7·10-3; в) 1,89·10-5; г) 28,9·10-7 |
| Задание №17 При окислении происходит: | Варианты ответа а) взаимодействие с кислородом б) перемещение электронной пары в) отдача электронов атомом, молекулой или ионом г) присоединение электронов |
| Задание №18 Е0 (MnO4/Mn2+)=1,51B; E0 (Cr2O72-/2Cr3+) = 1,33 B. Более сильным окислителем является: | Варианты ответа а) ионMnO4-;б) ионCr2O72-;в) ион Mn2+; г) ионCr3+ |
| Задание №19 Используя ряд активности металлов, определите в какой паре металлов можно получить наибольшее значение ЭДС в гальваническом элементе? | Варианты ответа а) Mn–Sn; б) Mn - Ag; в) Mn – Fe; г)Mn – Au |
| Задание №20 Среди приведенных ниже схем реакций укажите схемы реакций диспропорциони- рования: | Варианты ответа а) NH4NO3 →N2O + H2O, б) NH4NO2 → N2 + H2O, в) KClO3 →KClO4 + KCl, г) KClO3 → KCl + O2. |
Вариант тестового задания по теме « Химия элементов »
| Задание №1 В таблицах периодической системы элементов водороднаходится и в I, и в VII группах: | Варианты ответа а) потому что водород – газ, проявляющий неметаллическиесвойства; б) так как водо- род имеет на внешнем уровне один электрон идо завершения внешнего уровня ему не хватает одного электрона; в) так как водород неметалл, г) так как водород реагирует как с металлами, так и с неметаллами. |
| Задание №2 Водород не способен образовывать молекулы, состоящие более чем из двух атомов: | Варианты ответа а)потому что атомы водорода имеют только один не спаренный электрон и способны образовывать только одну электронную пару;б)потому что водород – газ, а молекулы всех газов состоят издвух атомов; в) возможно существование молекул водо- рода, содержащихболее двух атомов; г) возможно существование молекул водоро- да, содержащихменее двух атомов. |
| Задание №3 В ряду от Li к Fr | Варианты ответа а)усиливаются металлические свойства; б) уменьшаются металлические свойства; в) уменьшается атомный радиус; г) не изменяется атомный радиус. |
| Задание №4 Щелочные металлы обычно хранят под слоем керосина,таккак: | Варианты ответа а) их плотность меньше плотности воды, но больше плотности керосина; б) керосин ис- паряется медленнее воды;в) для предот- вращения взаимодействия металлов с кислородом и водой; г)для предотвращения взаимодействия металлов с кислородом |
| Задание №5 На воздухе металлический натрий покрывается белойпленкой: | Варианты ответа а) Na2О; б) Na3N; в) Na2О2; г) NaО2. |
| Задание №6 Почему известковая вода на воздухе мутнеет, а растворгидроксида калия - нет? | Варианты ответа а) раствор гидроксида калия не реагирует с составными частями воздуха; б) раствор гидроксида калия восстанавлива- ется составнымичастями воздуха до метал- лического кальция;в) карбонат кальция в отличии от карбоната калия в воде нераст- ворим; г) карбонат калия в отличии от карбоната кальция в воде нерастворим |
| Задание №7 Временная жесткость воды обусловлена присутствием вней: | Варианты ответа а) гидрокарбонатов кальция и магния; б) карбонатов кальция и магния; в) хлоридов кальция и магния; г)сульфатов кальция и магния. |
| Задание №8 Постоянная жесткость воды обусловлена присутствием | Варианты ответа а) хлоридов и сульфатов натрия и калия; б) хлоридов и сульфатов кальция и магния; в) хлоридов и карбонатов кальция и магния; г) гидрокарбонатов и карбонатов кальция и магния. |
| Задание №9 Постоянную жесткость воды нельзя устранить | Варианты ответа а) кипячением раствора; б) добавлением соды; в) пропусканием воды через ионообменную смолу; г) добавлением раствора гидрокарбоната натрия. |
| Задание №10 Максимальная масса озона, которую можно получить из16 гкислорода,равна: | Варианты ответа а)12 г; б) 24 г; в) 32 г; г)16 г. |
| Задание №11 Водород можно получить при взаимодействии: | Варианты ответа а) цинка с разбавленной азотной кислотой; б) меди с хлористоводородной кислотой; в) кальция с водой; г) при гидролизе гидрокарбоната натрия. |
| Задание №12 Вещества, содержащие только ковалентные полярные связи | Варианты ответа а)H3PO4, BF3, CH3COONH4; б) H2SO4,F2, P2O5 в)PF5, Cl2O7, NH4Cl; г) NO2, SOCl2, CH3COOH |
| Задание №13 Сила кислородсодержащих кислот хлора возрастает вследующей последовательности: | Варианты ответа а)HСlO; HСlO2; HСlO3; HСlO4; б)HСlO4; HСlO3; HСlO2; HСlO; в)они примерно одинаковы по силе; г)HСlO4; HСlO2; HСlO3; HСlO. |
| Задание №14 Какой из способов получения хлора, обычно не используют в лаборатории: | Варианты ответа а) окисление концентрированной соляной кислоты перманганатом калия; б) окисление концентрированной соляной кислоты дихроматом калия; в) окисление концентрированной соляной кислоты оксидоммарганца (IV); г) каталитическое окисление хлороводорода кислородомвоздуха. |
| Задание №15 Из приведенного перечня элементов: Li, Na, Ag, Au, Ca,Ba – к щелочным металлам относятся: | Варианты ответа а)всеметаллы; б)Li, Na, Ag, Au; в)Ca и Ba; г)Li и Na. |
| Задание №16 Как изменится растворимость азота в воде при повышении давления: | Варианты ответа а) увеличится; б) уменьшится; в) не изме-нится; г) мало изменится |
| Задание №17 Укажите реакцию, которая не используется при синтезеазотнойкислоты: | Варианты ответа а)N2 + 3H2= 2NH3; б) 4NH3 + 5O2 = 4NO + 6 H2O; в) 2HNO 2 = NO + NO2 + H2O; г) NO2 + O2=2NO2 |
| Задание №18 Для элементов IVВ группы характерны следующие степени окисления: | Варианты ответа a) +2; +4;б) +2; +3; в) +1; +3; +4; г) +2; +3; +4. |
| Задание №19 Для элементов VIB группы характерна следующая электронная конфигурация: | Варианты ответа а) d5S1иd4S2; б) d6S0иd4S2; в) d5S1; г) d4S2. |
| Задание №20 Какое вещество образуется при окислении уксусного альдегида по реакции «серебряного зеркала»: | Варианты ответа а) уксусная кислота; б) этилацетат в) этиловый спирт;г) глюкоза |
Вариант Домашнего задания:
1. При взаимодействии m г n-валентного металла с серной кислотой выделилось V мл (н.у.) водорода. Рассчитайте эквивалентную и мольную массы металла, массу прореагировавшей кислоты и массу образовавшейся соли. Какой металл был взят для растворения? Напишите реакцию взаимодействия этого металла с серной кислотой
| m, г | 0,08 | 0,10 | 0,12 | 0,16 | 0,18 |
| n | |||||
| V,мл (н.у.) | 27,4 | 124,5 | 89,6 | 147,5 | 72,2 |
2. Составьте электронную формулу атома элемента с порядковым номером Z. К какому электронному семейству принадлежит этот элемент?
| Z |
3. Определите тип химической связи в молекуле вещества А, изобразите ее структурную формулу.
| A | Аl2О3 | СS2 | СBr4 | РН3 | СаF2 |
4. Вычислите, какое количество теплоты выделится при восстановлении оксида А металлом Б, если было получено m г восстановленного металла.
| A | Fе2О3 | ТiO2 | Сr2О3 | СdО | РbО |
| Б | Аl | Са | Mg | Аl | Zn |
| m,г |
5. Рассчитайтестандартное изменение энтропии реакции, предварительно подобрав коэффициенты в уравнении, и установите, будет ли она протекать самопроизвольно в изолированной системе при стандартных условиях.
Реакции
NiO(т)+Al(т)=Ni(т)+Al2O3(т)
V(т) +CaO(т) =V2O5(т) +Ca(т)
SO2(г) +H2S(г) =S(т) +H2O(ж)
N2H4(г) +O2(г) =N2(г) +H2O(г)
PbS(т) +O2(г) =PbO(т) +SO2(г)
6. Равновесие в гомогенной газовой системе установилось в момент, когда прореагировало 50% вещества А. Вычислите константу равновесия, если концентрации исходных веществ СоА и СоВ,моль/л. В какую сторону сместится равновесие при повышении давления?
| Система | СоА | СоВ |
| 2А+2В=С+2D; | 1,1 | 2,5 |
| А+4В =2С+2D; | 0,8 | 2,6 |
| 3А+ В =С+ЗD; | 1,2 | 0,8 |
| 2А+3В=С+ЗD; | 0,3 | 0,7 |
| А +2В =2С+D. | 1,0 | 1,6 |
7. Вкакой массе воды нужно растворить 100 г вещества А, чтобы получить Х%-ный по массе раствор? Какова молярность этого раствора, если его плотность равна ρ г/мл?
| A | АlСl3 | ВаСl2 | Са(NО3)2 | Н3РO4 | К2СО3 |
| X, % | |||||
| ρ,г/мл,,г/мл | 1,10 | 1,25 1,_ ~> | 1,08 | 1,10 | 1,05 |
8. Составьте уравнения гидролиза солей А и Б в молекулярной и ионно-молекулярной формах. Запишите уравнение совместного гидролиза этих солей в молекулярной форме, если одним из продуктов совместного гидролиза является гидроксид металла соли А.
| A | CrCl3 | Zn(NO3)2 | АlСl3 | Gа2(SО4)3 | |
| Б | K2S | K2CO3 | СН3СООNаНСООNа Li2CO3 | Nа2Sе | Nа2СО3 |
9. Дана схема гальванического элемента. Напишите электронные уравнения электродных процессов и уравнение токообразующей реакции, протекающих в этом элементе.Рассчитайте ЭДС элемента, если концентрация потенциалопределяющих ионов отрицательного электрода равна С1 моль/(кг воды), положительного электрода - С2 моль/(кг воды).
| Схема гальванического элемента | С1 | С2 |
| (-)Nb/Nb(NO3)3//Со(NO3)2/Со(+); | 1,0 | 1,0 |
| (-)Сг / Сг2(SО4)3 //NiSО4 /Ni (+); | 1,5 | 2,0 |
| (-) Аl/АlС1з//PtCl2/Pt (+); | 2,0 | 3,0 |
| (-) Fе/Fе(SО4)//СdSО4/Сd (+); | 2,5 | 4,0 |
| (-) Cr/ CrCl3 // CuSO4/Cu (+) | 3,0 | 5,0 |
В конце освоения дисциплины студент сдает экзамен, где ему предлагается ответить в устной форме на два вопроса из приведенного ниже списка
Вопросы к экзамену в первом семестре
1. Понятие об эквиваленте. Закон эквивалентов. Вычисление эквивалентных масс и эквивалентных объемов.
2. Атомные ядра и их состав. Изотопы. Квантово - механическая модель атома. Волновое уравнение Шредингера и результаты его решения для атома водорода и водородоподобных атомов.
3. Принцип Паули. Правило Гунда. Правила и порядок заполнения атомных орбиталей. Строение многоэлектронных атомов.
4. Периодическая система элементов Д. И. Менделеева. Периодический закон. Изменение свойств элементов. Кислотно-основные и окислительно-восстановительные свойства соединений. Значение периодического закона Д. И. Менделеева.
5. Основные типы и характеристики химической связи. Ковалентная связь и механизм ее образования. Свойства ковалентной связи. Ионная связь и её свойства.
6. Метод валентных связей. Метод молекулярных орбиталей. Строение и свойства простейших молекул.
7. Основные виды межмолекулярного взаимодействия. Водородная связь. Донорно-акцепторная связь.
8. Строение комплексных соединений. Комплексы, комплексообразователи, лиганды, заряд и координационное число комплексов.
9. Внутренняя энергия и энтальпия систем. Первый закон термодинамики. Энтальпия образования химических соединений. Закон Гесса и следствия из него.
10. Понятие об энтропии и ее изменении в химических превращениях. Энергия Гиббса. критерий самопроизвольного протекания реакций в изобарно-изотермических условиях.
11. Гомогенные и гетерогенные реакции. Скорость гомогенных химических реакций. Факторы, влияющие на скорость реакций.
12. Закон действия масс. Кинетическое уравнение. порядок и молекулярность реакции. Уравнение Аррениуса. Правило Вант-Гоффа. Энергия активации.
13. Химическое равновесие. Обратимые и необратимые реакции. Константа химического равновесия. Ее связь с термодинамическими характеристиками системы.
14. Принцип Ле-Шателье – Брауна. Гомогенный и гетерогенный катализ. Механизм гомогенного катализа.
15. Понятие о растворах. Способы выражения количественного состава растворов.
16. Сильные и слабые электролиты. Ионообменные реакции и равновесия.
17. Электролитическая диссоциация воды. Константа ионного произведения воды. Водородный показатель. Гидролиз солей.
18. Гетерогенные равновесия. Произведение растворимости.
19. Окислительно-восстановительные реакции. Важнейшие окислители и восстановители.
20. Окислительно-восстановительный потенциал. Уравнение Нернста. Водородный электрод сравнения.
21. Щелочные и щелочноземельные металлы и их соединения: Свойства, нахождение в природе, получение и применение.
22. Жесткость воды и способы ее устранения.
23. Получение, физические и химические свойства азота, аммиака, азотной кислоты.
24. Свойства, получение, применение фосфора и его соединений
25. Получение, физические и химические свойства серы, ее оксидов, гидридов и гидроксидов.
26. Состав, свойства, получение, применение галогеноводородов, галогенидов металлов, кислородсодержащих кислот галогенов и их солей.
27. Свойства, получение, применение углерода и его неорганических соединений.
28. Свойства, получение, применение кремния и его соединений.
Вопросы к экзамену во втором семестре
1. Понятие о гибридизации атома углерода.
2. Электронные эффекты в молекулах органических соединений.
3. Способы разрыва химической связи. Характеристика реакционных частиц в органической химии.
4. Классификация органических реакций. Равновесия и скорости, катализ органических реакций
5. Общая классификация органических соединений, гомологические ряды и функциональные группы.
6. Понятие изомерии.Поворотная изомерия (конформации). Конформеры.
7. Геометрическая изомерия. Оптическая изомерия. Энантиомеры.
8. Общая формула, гомологический ряд, строение, основные методы синтеза, химические свойства алканов.
9. Общая формула, гомологический ряд циклоалканов, строение, изомерия, номенклатура. Методы получения, химические свойства, использование циклоалканов
10. Природные источники углеводородов. Пиролиз и крекинг. Моторное топливо.
11. Номенклатура и изомерия алкенов. Методы получения олефинов. Строение алкенов. Химические свойства
12. Общая формула, классификация диенов. Строение, свойства, способы получения сопряженных диенов. Строение и свойства кумулированных диенов (алленов).
13. Общая формула, гомологический ряд алкинов, строение, изомерия, номенклатура. Методы получения, химические свойства, использование алкинов
14. Общая формула, гомологический ряд алкадиенов, строение, изомерия, номенклатура. Методы получения, химические свойства, использование алкадиенов.
15. Правила ориентации при реакциях электрофильноо замещения. Заместители 1 и 2-го рода.
16. Спирты: Общая формула. Строение, номенклатура и изомерия. Методы получения спиртов: Физические свойства. Водородная связь. Химические свойства спиртов.
17. Фенолы и нафтолы: строение и изомерия. Способы получения. Физические и химические свойства фенолов и нафтолов.
18. Альдегиды и кетоны: строение, изомерия и номенклатура, химические свойства.
19. Карбоновые кислоты: Представители и номенклатура кислот. Природа карбоксильной группы. Промышленные методы синтеза. Химические свойства. Производные карбоновых кислот. Особенности их строения и свойств.
20. Поверхностно-активные вещества: классификация, строение, свойства.
21. Амины: состав, строение, изомерия и номенклатура. Сравнительная характеристика ароматических и алифатических аминов. Получение аминов. Химические свойства аминов.
22. Протеиногенные аминокислоты: строение, классификация, особенности физических и химических свойств, амфотерность, изоэлектрическая точка, пептидная связь.
23. Полипептиды. Белки. Первичные, вторичные, третичные и четвертичные структуры белков.
24. Углеводы. D- и L- моносахариды. Глюкоза и фруктоза. Химические свойства. Дисахариды восстанавливающие и невосстанавливающие. Полисахариды: крахмал и клетчатка..
25. Липиды. Жиры и масла. Понятие о фосфолипидах.
26. Нуклеиновые кислоты. Понятие о состоянии, составе и строении ДНК и РНК.
27. Реакции полимеризации и поликонденсации. Типы полимеров.
28. Экологические аспекты использования и переработки полимерных изделий Биологическая разлагаемость полимеров
 2015-08-21
2015-08-21 1245
1245







