Вычислить окислительно-восстановительный потенциал системы 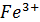 +e=
+e= 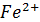 , если [
, если [ 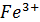 ] = 0,005 моль/л, [
] = 0,005 моль/л, [ 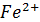 ] = 0,1 моль/л,
] = 0,1 моль/л, 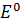 = 0,771 В.
= 0,771 В.
Решение:
По формуле (4), полагая
E = 0,771 + 0,059* lg 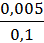 = 0,695 В
= 0,695 В
Количественно глубину протекания обратимой реакции (1) характеризует константа равновесия
Kp = 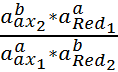 (5)
(5)
Величина константы может быть вычислена, если воспользоваться стандартными нулевыми потенциалами:
Kp = 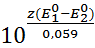 (6)
(6)
Здесь z - общее число электронов, участвующих в окислительно-восстановительном процессе, z = a 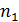 = b
= b 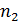 . Потенциал
. Потенциал 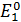 относится к окислителю, а
относится к окислителю, а 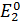 - восстановителю.
- восстановителю.
 2015-08-12
2015-08-12 435
435








