Вычислить 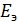 при титровании железа (II) перманганатом при рН=0.
при титровании железа (II) перманганатом при рН=0.
Решение:
В соответствии с реакцией в примере (3) 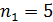 ,
, 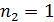
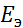 =
= 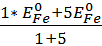 =
= 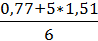 = 1,386 В
= 1,386 В
Пример 6:
Вычислить потенциал в точке эквивалентности при титровании 0,1 н раствора железа (II) 0,1 н раствором дихромата калия при рН=0. 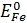 = 0,77 В,
= 0,77 В,
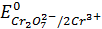 =
= 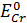 = 1,33 В
= 1,33 В
Решение:
Уравнение реакции
1│ 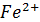 -
- 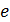 =
= 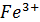 x=1
x=1
6│ 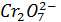 + 14
+ 14 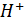 + 6e =
+ 6e = 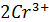 + 7
+ 7 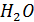 y=2
y=2
___________________________________
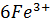 +
+ 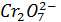 + 14
+ 14 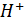 + =
+ = 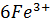 +
+ 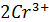 + 7
+ 7 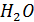
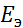 =
= 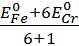 –
– 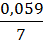 lg2[
lg2[ 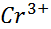 ]
]
число эквивалентов 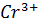 в точке эквивалентности равно числу эквивалентов железа (II), т.е.
в точке эквивалентности равно числу эквивалентов железа (II), т.е. 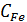 *
* 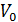 = [
= [ 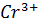 ] * V. Здесь
] * V. Здесь 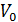 И V - исходный объем раствора и объем в точке эквивалентности, причем по условию V = 2
И V - исходный объем раствора и объем в точке эквивалентности, причем по условию V = 2 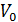 , Отсюда
, Отсюда 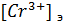 =
= 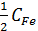 - Потенциал
- Потенциал 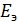 равен:
равен:
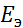 =
= 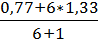 –
– 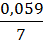 lg2(
lg2(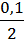 ) = 1,24 В
) = 1,24 В
Задачи:
68. Изобразить схему и описать функции стеклянного электрода.
69. Изобразить схему и описать функции платинового электрода,
70. Изобразить схему и описать функции хлорид-серебряного электрода.
71. Изобразить схему и описать функции каломельного электрода.
72. Изобразить гальваническую цепь из хлорид-серебряного и платинового электродов.
73. Изобразить гальваническую цепь из водородного и платинового электродов.
|
|
|
74. При титровании к 20 мл 0,018 н. раствора 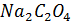 добавили 18 мл 0,021 н. раствора Ce
добавили 18 мл 0,021 н. раствора Ce 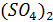 . Рассчитать потенциал полученного раствора.
. Рассчитать потенциал полученного раствора.
Ответ: 1,66B.
75. Вычислить потенциал раствора, если при титровании к 15 мл 0,02 н. раствора 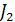 прибавили 18 мл 0,017 н. раствора
прибавили 18 мл 0,017 н. раствора 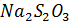 .
.
Ответ: 0,24В.
76. При титровании к 10 мл 0,02 н. раствора 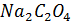 добавили 13 мл 0,015 н. раствора
добавили 13 мл 0,015 н. раствора 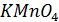 . Рассчитать потенциал полученного раствора, если его рН=О.
. Рассчитать потенциал полученного раствора, если его рН=О.
Ответ: - 0,384В.
77. Рассчитать скачок потенциала в пределах ± 0,10 от точки эквивалентности при титровании 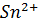 раствором
раствором 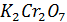 при рН=3.
при рН=3.
Ответ: ∆Е= 0,904В.
78. На титрование 0,1775 r йода затрачено 15,45 мл раствора тиосульфата. Найти титр раствора 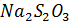 *5
*5 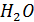 .
.
Ответ: Т=2,25 * 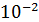 г/мл.
г/мл.
79. Титр раствора 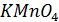 по щавелевой кислоте (
по щавелевой кислоте (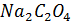 *2
*2 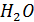 ) равен 0,0024 г/мл. Найти нормальность раствора перманганата.
) равен 0,0024 г/мл. Найти нормальность раствора перманганата.
Ответ: 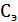 = 0,038 моль-экв/л.
= 0,038 моль-экв/л.
80. Раствор 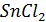 оттитрован бихроматом на 50%. Вычислить потенциал раствора.
оттитрован бихроматом на 50%. Вычислить потенциал раствора.
Ответ: Е = 0,151 В.
 2015-08-12
2015-08-12 2973
2973







