Активность – это общая скорость реакции на катализаторе и она может быть рассчитана по формуле (6.71):
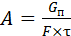 , (6.71)
, (6.71)
где G п – количество превращенного реагента за времяtна единице поверхности F.
Активность катализатора характеризуется мерой его ускоряющего воздействия по отношению к данной реакции.
Время от момента загрузки свежего катализатора в реактор до момента выгрузки отработанного катализатора из реактора называется циклом его работы. Активность катализатора неодинакова в разные периоды его эксплуатации.
Весь цикл работы катализатора, связанный с изменением его активности, можно разделить на три периода:
– разработка катализатора;
– период постоянной активности – срок жизни катализатора;
– дезактивация катализатора.
В период разработки происходит самопроизвольный рост активности катализатора под воздействием реакционной среды.
Период постоянной активности для разных катализаторов может меняться в широких пределах: от нескольких минут до нескольких лет, требования к сроку жизни катализатора определяются стоимостью замены дезактивированного катализатора свежим катализатором и возможностью его регенерации. При высокой стоимости замены сокращение числа этих операций дает весьма ощутимый экономический эффект.
Период падения активности катализатора связан с его дезактивацией, которая может быть обусловлена явлениями старения, утомления, зауглероживания, синтеринга, отравления контактными ядами.
Старение – это естественный процесс, при котором активность постепенно уменьшается по всему слою катализатора. Старение может быть вызвано различными факторами, например длительным воздействием высоких температур, истиранием частиц катализатора при трении друг о друга. Как правило, быстрее стареют более мелкие частицы твердого катализатора.
Утомление – это неравномерное падение активности в слое катализатора – опасный процесс, так как проявляется задолго до истечения срока жизни катализатора в результате неправильной его загрузки и эксплуатации. Утомление характерно для процессов в стационарном слое катализатора.
Зауглероживание происходит в процессах переработки углеводородного сырья. Катализатор покрывается углеродистыми отложениями (коксом) в форме высококонденсированных ароматических структур, которые образуются в результате глубоких химических превращений. Среди подобных процессов можно назвать каталитический крекинг и риформинг, гидрокрекинг, дегидрирование и изомеризацию. Отложения кокса блокируют поверхность катализатора, вследствие чего его активность резко снижается за короткое время, которое иногда составляет 10 – 30 мин. Зауглероженный катализатор поддается восстановлению, например, в процессе каталитического крекинга восстановление зауглероженного катализатора достигается в регенераторе при повышенной температуре путем выжига кокса кислородом воздуха.
Синтеринг (спекание) обычно является результатом окислительной регенерации, во время которой температура катализатора достигает 6000C и выше, либо следствием высокотемпературного процесса с плохо организованным теплоотводом. Спекание сокращает величину активной поверхности в результате укрупнения кристаллитов металлического или оксидного катализатора и повышает гидравлическое сопротивление аппарата. Поэтому одной из задач в решении этой проблемы является стабилизация структуры компонентов катализатора. Стабилизация осуществляется путем структурного промотирования. Таким промотором, например, при синтезе аммиака служит оксид алюминия Al2O3, который, внедряясь между кристаллами железа, предотвращает их агломерацию. Аналогичное действие оказывает на никелевый катализатор в процессе гидрирования углеводородов оксид хрома Cr2O3.Не менее важной является также стабилизация носителя, ибо он обеспечивает металлическому катализатору высокоразвитую поверхность.
Отравление – это частичная либо полная потеря активности катализатора под действием веществ, называемых контактными ядами. При отравлении наблюдается специфическое действие яда по отношению и к катализатору, и к самой реакции.
Механизм отравления металлических катализаторов контактными ядами может быть связан:
– с воздействием молекул, содержащих неметаллы N, P, As, O, S, Se. Это могут быть и свободные элементы из этой группы, кроме азота. Они связывают металл катализатора за счет неподелённых электронных пар (сероводород, тиофен, арсин, фосфин и другие соединения.);
– с отсоединением металлов (ионов Hg, Pb, Bi, Sn, Cd, Fe) с последующим образованием интерметаллических соединений с участием d- электронов;
– с воздействием молекул, содержащих кратные связи (СО, НСN), с более высокими адсорбционными характеристиками, чем другие вещества реакционной массы.
Катализатор защищают от контактных ядов несколькими приемами:
– переводом яда в неактивное состояние;
– очисткой сырья от контактных ядов на стадии его подготовки;
– применением катализаторов, устойчивых к контактным ядам.
В качестве примера использования первого способа защиты можно привести прием удаления СО, содержащегося в поступающем на синтез аммиака водороде, с помощью самого водорода по реакции (6.72) (СО – контактный яд для железного катализатора):
СО + 3Н2 = CH4 + H2O. (6.72)
Получаемый метан – инертная примесь к водороду – и поэтому не представляет вреда для катализатора.
Примером второго способа защиты платинового катализатора процесса риформинга является предварительная гидроочистка бензиновых фракций от серо-, азот- и кислородсодержащих соединений по реакциям (6.73 – 6.75):
RSH + H2 = RH + H2S, (6.73)
RNH2 + H2 = RH + NH3, (6.74)
ROH + H2 = RH + H2O. (6.75)
Приведенные реакции протекают на стойком к действию каталитических ядов алюмо-кобальт-молибденовом катализаторе (АКМ).
Именно разработка каталитических композиций, стойких к ядам, является наиболее интересным и перспективным направлением совершенствования каталитических систем.
Указанные способы защиты катализаторов от ядов не являются независимыми друг от друга и поэтому могут применяться в одном процессе одновременно.
Еще одной причиной падения активности катализатора является отложение на его поверхности минеральных примесей, содержащихся в сырье. Эти примеси хемосорбируются, изменяя химический состав поверхности катализатора.
Селективность (избирательность) – важнейший показатель качества катализатора. Она измеряется величиной относительной скорости образования целевого продукта:
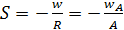 , (6.76)
, (6.76)
где wA – скорость образования целевого продукта, рассчитанная по реагенту А;
A = R – общая скорость реакции (активность).
Если одновременно возможно протекание нескольких параллельных реакций, то можно подобрать для каждой из них собственные селективные катализаторы. Например, дегидратация этанола может протекать в присутствии оксида алюминия или оксида тория преимущественно с образованием этилена и воды по реакции (6.77):
С2Н5ОН ↔ Н2О + С2Н4. (6.77)
В присутствии металлических катализаторов (серебра, меди) этанол практически полностью дегидрируется по реакции (6.78):
С2Н5ОН = СН3СНО + Н2. (6.78)
В присутствии бифункционального катализатора (Al2O3 + ZnO) с достаточно высокой скоростью протекают реакции дегидратации и дегидрирования с образованием 1,3-бутадиена (6.79):
2С2Н5ОН ↔ 2Н2О + С4Н6 + Н2. (6.79)
Величина селективности может изменяться в широких пределах, в зависимости от самого катализатора и технологического процесса. Принято считать приемлемой селективность величиной не менее 0,85.
Селективность зависит от многих факторов. Один из них – число координационных мест у активного атома поверхности. Наибольшей селективностью обладают катализаторы кристаллической структуры с большей однородностью активных центров. Другими факторами, влияющими на селективность, являются природа и структура носителей, а также природа сырья. К примеру, нефтехимическое и углехимическое сырье различают по групповому составу и характеру примесей. Поэтому промышленные катализаторы должны обладать достаточной гибкостью к переработке сырья разного состава без потери селективности.
Производительность катализатора измеряют количеством продукта, которое можно получить в единицу времени с единицы объема катализатора:
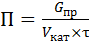 , (6.80)
, (6.80)
где G пр – масса продукта, кг,
V кат – объём катализатора, м3,
τ – время, час.
Температура зажигания катализатора (Т з) – минимальная температура, при которой процесс начинает протекать с достаточной для технологических целей скоростью. Чем выше активность катализатора, тем ниже температура зажигания. Они связаны формулой (6.81):
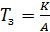 , (6.81)
, (6.81)
где K – константа, определяемая природой катализатора.
При низкой температуре зажигания расширяется рабочий интервал между Т з и режимной температурой процесса, упрощается конструкция реактора, сокращаются энергетические затраты, стабилизируется технологический режим. Для экзотермических процессов при некотором значении температуры зажигания количество выделяющегося тепла становится равным отводимому теплу. В этом случае температура зажигания является той минимальной температурой, при которой обеспечивается автотермичность процесса.
Особенно важно иметь невысокую температуру зажигания катализатора для проведения обратимых экзотермических реакций, когда невысокие температуры проведения процесса позволяют сместить равновесие в сторону получения ее продуктов.
Механическая прочность катализатора должна быть такой, чтобы он не разрушался под собственной массой в реакторах со стационарным слоем катализатора и не истирался в процессах с кипящим слоем катализатора. Именно из-за отсутствия износостойких катализаторов зачастую сдерживается перевод ряда химико-технологических процессов из стационарного в кипящий слой катализатора.
Термостойкость катализатора – требования к этому показателю достаточно жесткие. Он должен выдерживать перегрев до температуры, превышающей регламентную на 50 – 1000С. Это важно с точки зрения возможности регенерации катализатора. К примеру, в каталитическом крекинге углеводородного сырья рабочая температура в реакторе равна 480 – 5300С, а температура регенерации катализатора – 600 – 6200С.
 2015-08-21
2015-08-21 4095
4095








