Гетерогенная каталитическая реакция A → B протекает в несколько стадий, последовательность которых может быть описана следующей схемой:
– диффузия реагента А из потока сырья к внешней поверхности катализатора (внешняя диффузия);
– диффузия А в порах катализатора к его внутренней поверхности (внутренняя диффузия);
– адсорбция (хемосорбция) реагента А на внутренней поверхности катализатора;
– химическая реакция на внутренней поверхности катализатора;
– десорбция продукта В с внутренней поверхности в порах катализатора;
– диффузия продукта В из пор катализатора к его поверхности;
– диффузия продукта В от внешней поверхности катализатора в поток.
Анализ влияния отдельных стадий на общую скорость процесса показывает, что наиболее предпочтительно проводить процесс в кинетической области, так как в этом случае отсутствует диффузионное торможение, и скорость реакции будет определяться соотношением скоростей адсорбции реагента и десорбции продукта. Для ускорения такой реакции применяют вариации кинетических факторов: температуры, давления, концентрации, подбор катализатора.
В предыдущей теме было отмечено, что в зависимости от того, какая из стадий протекает с меньшей скоростью, различают кинетически и диффузионно контролируемые области протекания гетерогенно-каталитических процессов.
Более детально различают четыре области протекания гетерогенно-каталитических процессов:
– внешнедиффузионную – скорость процесса в целом определяется скоростью диффузии реагентов из потока к внешней поверхности зерна катализатора (или диффузия продуктов от нее в поток);
– внутридиффузионную, когда скорость лимитируется диффузией реагентов из потока от внешней поверхности зерна катализатора к его внутренней поверхности (или наоборот – для продуктов реакции);
– внешнекинетическую, когда скорость процесса лимитируется самой химической реакцией на внешней поверхности зерна катализатора.
– внутрикинетическую, когда скорость процесса определяется скоростью химической реакции, причем реакция протекает на внутренней поверхности зерна катализатора, что возможно, если химическая реакция идет медленнее и внешней, и внутренней диффузии.
На практике четкой границы между указанными областями протекания процесса не существует, поэтому проводят анализ поведения реакционной каталитической системы также в промежуточных (переходных) областях. Далее рассмотрим подробнее особенности протекания гетерогенно-каталитического процесса в условиях внешней и внутренней диффузии.
6.3.1. Внешняя диффузия
Как уже было показано, в условиях внешней диффузии наиболее медленной стадией гетерогенно-каталитической реакции является перенос реагента из объема к внешней поверхности зерна катализатора или перенос продуктов процесса в обратном направлении. По теории стационарной конвективной диффузии Нернста вблизи поверхности твердого тела (например, зерна катализатора) образуется диффузионный слой, толщина которого d существенно зависит от скорости движения газового или жидкого потока относительно твердой поверхности. Допускается, что внутри диффузионного слоя конвекция отсутствует и происходит основное изменение концентрации между объемом и поверхностью.
Метод определения скорости процесса, протекающего во внешнедиффузионной области, предложил Д.А. Франк-Каменецкий. Этот метод получил название метода равнодоступной поверхности.
При стационарном режиме концентрация реагента внутри диффузионного слоя меняется линейно с расстоянием до поверхности катализатора, поэтому градиент концентрации можно записать в виде (6.47):
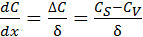 , (6.47)
, (6.47)
где CS – концентрация вещества у внешней поверхности катализатора;
СV – концентрация вещества в объеме газовой (жидкой) фазы.
По первому закону Фика скорость диффузии, отнесенная к единице площади поверхности катализатора, пропорциональна градиенту концентрации (6.48):
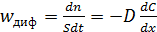 , (6.48)
, (6.48)
где D – коэффициент диффузии, м2/с,
S – площадь поверхности катализатора, на которой происходит диффузия, м2,
С – концентрация, моль/м3.
После подстановки соотношения (6.47) в формулу (6.48) получим (6.49):
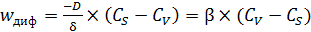 . (6.49)
. (6.49)
Здесь b – коэффициент массопередачи между объемом газовой либо жидкой фазы и внешней поверхностью катализатора, он зависит от размера зерен и толщины диффузионного слоя, возрастая с их уменьшением.
Диффузия реагента к поверхности катализатора сопровождается протеканием каталитической реакции, скорость которой для реакции первого порядка пропорциональна поверхностной концентрации вещества (6.50):
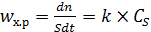 . (6.50)
. (6.50)
В стационарном состоянии скорости реакции и диффузии равны (6.51):
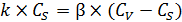 . (6.51)
. (6.51)
Выразим CS из формулы (6.51) как
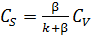 (6.52)
(6.52)
и, подставив выражение (6.52) в формулу (6.50), получим общее выражение скорости для гетерогенно-каталитического процесса, отвечающее кинетике реакции первого порядка (6.53):
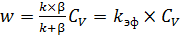 . (6.53)
. (6.53)
Рассмотрим предельные случаи уравнения (6.53). Если 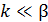 (диффузия к поверхности катализатора происходит быстрее химической реакции), то величиной k в знаменателе уравнения (6.53) можно пренебречь, и оно становится уравнением первого порядка относительно CV (6.54):
(диффузия к поверхности катализатора происходит быстрее химической реакции), то величиной k в знаменателе уравнения (6.53) можно пренебречь, и оно становится уравнением первого порядка относительно CV (6.54):
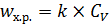 (6.54)
(6.54)
Анализируя уравнения (6.50), (6.53) и (6.54), получаем k эф = k и 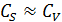 .
.
Такую область протекания каталитического процесса называют внешнекинетической.
Если 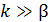 (химическая реакция протекает существенно быстрее диффузии), то уравнение (6.53) принимает вид:
(химическая реакция протекает существенно быстрее диффузии), то уравнение (6.53) принимает вид:
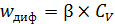 . (6.55)
. (6.55)
Анализируя уравнения (6.49), (6.53) и (6.54), получаем:
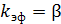 , (6.56)
, (6.56)
и
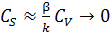 . (6.57)
. (6.57)
Такую область протекания каталитического процесса называют внешнедиффузионной.
Если коэффициенты b и k соизмеримы, то считают, что процесс протекает в промежуточной о бласти.
6.3.2. Внутренняя диффузия
Большинство промышленных катализаторов имеют суммарную площадь внутренней поверхности пор на несколько порядков больше площади внешней поверхности катализатора.
Характер массопереноса внутри пор отличается от внешней (молекулярной) диффузии и зависит во многом от длины свободного пробега молекул l и диаметра поры d.
В узких порах, если l > d, существенно возрастает возможность столкновения молекулы со стенкой поры. В этих условиях эффективный коэффициент диффузии пропорционален диаметру поры. В широких порах l < d, считают, что массоперенос подчиняется закону Фика для молекулярной диффузии в объеме и в этом случае коэффициент диффузии пропорционален длине свободного пробега молекул l. При протекании внутри пор гетерогенно-каталитической реакции надо также учитывать дополнительный поток вещества внутри поры за счет разности давлений (внешнего и внутри поры).
Имеются разные модели, с помощью которых описываются процессы массопереноса при внутридиффузионном протекании их в зерне катализатора. Далее рассмотрим модель, предложенную советским ученым Я.Б. Зельдовичем.
Я.Б. Зельдович рассматривает пористое зерно катализатора в виде сплошной однородной неподвижной среды, куда линейным массопереносом подводится с поверхности реагент, вступающий затем на стенках поры в реакцию, а продукты реакции диффундируют к поверхности.
Согласно этой модели, пора направлена вдоль максимального градиента концентрации реагента от внешней поверхности к центру зерна. Для сферического зерна пора является конической. Адсорбция реагента на поверхности катализатора не учитывается. При протекании внутри зерна катализатора реакции первого порядка A → B второй закон Фика при стационарной линейной диффузии может быть представлен следующим образом (6.58):
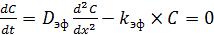 , (6.58)
, (6.58)
где D эф – эффективный коэффициент диффузии вещества A в поре зерна,
k эф – эффективная константа скорости реакции.
В равенстве (6.58) первое слагаемое указывает на изменение количества вещества A в процессе диффузии, а второе – за счет каталитической реакции. При этом знак минус указывает на расходование вещества A.
Уравнение (6.58) решают при различных краевых условиях.
Первое условие: С = СA при х = 0 (х – расстояние от поверхности зерна). Здесь СA – концентрация вещества A на поверхности зерна.
Второе условие: 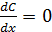 при х = ½ d (d – диаметр зерна).
при х = ½ d (d – диаметр зерна).
Суть второго условия состоит в том, что диффузия от поверхности поры при х = 0 и х = d к ее центру симметрична, поэтому касательная кривой в координатах (С; х) при х = ½ d горизонтальна.
Запишем решение (6.58) в форме (6.59):
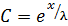 , (6.59)
, (6.59)
где l– коэффициент.
Далее, взяв вторую производную от С, подставим полученный результат в равенство (6.58) и получим уравнение (6.60):
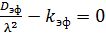 . (6.60)
. (6.60)
Извлекая квадратный корень из него, находим выражения для коэффициентов
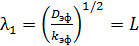 и
и 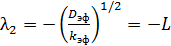 . (6.61)
. (6.61)
В результате имеем два частных решения уравнения (6.58):
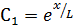 и
и 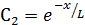 (6.62)
(6.62)
и общее решение принимает вид (6.63):
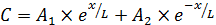 , (6.63)
, (6.63)
где А 1 и А 2 – коэффициенты.
С учетом первого из краевых условий (С = СA) можно записать:
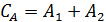 и
и 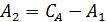 . (6.64)
. (6.64)
На основе второго краевого условия можно записать:
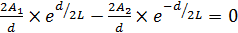 или
или 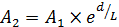 . (6.65)
. (6.65)
Совместное решение равенств (6.64) и (6.65) позволяет вычислить коэффициенты А 1и А 2:
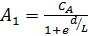 и
и 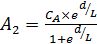 . (6.66)
. (6.66)
После подстановки значений А 1 и А 2 из выражения (6.66) в уравнение (6.63) получаем искомую зависимость концентрации реагента от параметра х в интервале от входа в пору до ее центра (0 ≤ х = r):
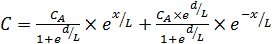 . (6.67)
. (6.67)
Из уравнения (6.67) найдем соотношение концентраций реагента A в центре и на поверхности зерна:
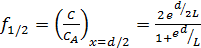 . (6.68)
. (6.68)
Величина f 1/2 характеризует степень использования внутренней поверхности поры. Рассмотрим предельные случаи.
Первый случай. 1 ≥ f 1/2 ≥ 0,99 или 1 – f 1/2 ≤ 0,01, и концентрация реагента в центре зерна фактически не отличается от его поверхностной концентрации, и поэтому скорость процесса лимитируется не массопереносом, а скоростью химической реакции на внутренней поверхности зерна катализатора. Это значит, что катализатор работает во внутрикинетической области. Тогда параметр L больше размера зерна в несколько раз. Таким образом, во внутрикинетической области скорость процесса не зависит от размера зерен катализатора, но в реальных процессах эффективнее использовать крупные зерна для снижения гидравлического сопротивления потоку газа или жидкости через слой катализатора.
Второй случай. f 1/2 ≤ 0,01, то есть концентрация реагента в центре зерна близка к нулю, что, по-видимому, связано с трудностями внутреннего массопереноса. Это значит, что катализатор работает во внутридиффузионной области. Тогда параметр L существенно меньше размера зерна. Можно выделить отличительные признаки протекания процесса во внутридиффузионной области.
Количество вещества A, подаваемое на внутреннюю поверхность зерна, равно тому количеству, которое поступает за счет внешней (линейной) диффузии на поверхность зерна у устья поры, поэтому для определения скорости массопереноса внутрь зерна используем первый закон Фика:
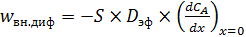 . (6.69)
. (6.69)
Если провести преобразование и отнести w вн. диф к единице объема пористого катализатора, то получим уравнение (6.70):
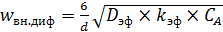 (6.70)
(6.70)
Из выражения (6.70) следует, что скорость процесса в этой области контролируется не только диффузией (через D эф), но и химической реакцией (через k эф). В отличие от внешнедиффузионной области здесь отсутствует лимитирующая стадия.
Параметр L существенно влияет на процесс в целом. Уменьшение L приводит к уменьшению толщины рабочего слоя зерна. При значительном уменьшении L процесс может перейти во внешнекинетическую область, так как сама реакция успевает пройти на внешней поверхности зерна. Объемная скорость процесса, согласно выражению (6.70), возрастает с уменьшением диаметра зерна, то есть с измельчением катализатора.
Из анализа уравнения (6.70) с учетом слабой зависимости D эф от температуры следует, что наблюдаемая энергия активации во внутридиффузионной области примерно равна половине энергии активации реакции во внутрикинетической области.
 2015-08-21
2015-08-21 7468
7468
