В механических системах самопроизвольно протекают процессы, в которых уменьшается потенциальная энергия, т.е. критерием самопроизвольности служит неравенство Δ E п<0. Для химических процессов имеются аналогичные критерии. В XIX веке таким критерием считали выполнимость условия Δ H <0 (принцип Бертло). Это казалось правдоподобным, т.к. при Δ H <0 (в экзотермической реакции) система переходит в состояние с меньшей энергией. Однако впоследствии было обнаружено много нарушений принципа Бертло (невозможность протекания некоторых экзотермических реакций и возможность – некоторых эндотермических). Поэтому принцип Бертло в настоящее время не применяется. Его нарушение связано с влиянием энтропии.
Состояние вещества можно охарактеризовать двояко: 1) Указать значения измеряемых свойств, например, температуру и давление. Это характеристики макросостояния. 2) Указать мгновенные характеристики каждой частицы вещества – ее положение в пространстве, скорость и направление перемещения. Это характеристики микросостояния.
Поскольку тела состоят из огромного количества частиц, то данному макросостоянию соответствует колоссальное число различных микросостояний. Это число называется термодинамической вероятностью W. С ней связано одно из фундаментальных свойств вещества – энтропия:
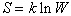 ,
,
где k – постоянная Больцмана.
Энтропию измеряют в Дж/К, а для одного моля – в Дж/(моль·К). По смыслу энтропия является мерой неупорядоченности системы. Так, для одного и того же вещества она имеет наибольшее значение в газообразном состоянии и наименьшее – в твердом, а для разных веществ в одном и том же агрегатном состоянии определяется сложностью структуры молекул. Любая система имеет тенденцию к самопроизвольному росту энтропии (Δ S >0). С другой стороны, согласно принципу Бертло, имеется тенденция к снижению энтальпии (Δ H <0). Эти два фактора учитываются в уравнении изобарно-изотермического потенциала:
G = H – TS,
где T – абсолютная температура.
Величина G называется также энергией Гиббса и является одним из важнейших термодинамических потенциалов. При постоянных температуре и давлении изменение энергии Гиббса в процессе определяет возможность его самопроизвольного протекания:
Δ G =Δ H – T Δ S
Если для некоторой реакции Δ G <0, то она может протекать самопроизвольно, при Δ G >0 реакция принципиально неосуществима; Δ G =0 отвечает состоянию равновесия.
График зависимости Δ G от температуры может иметь различный вид в зависимости от знаков Δ H и Δ S (рисунок 1.1).
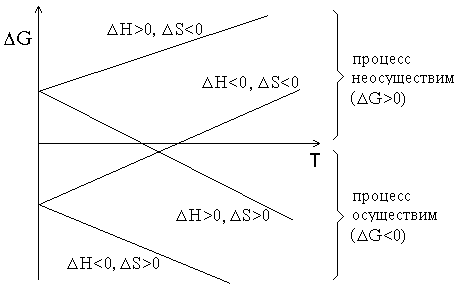
Рисунок 1.1 – Графики зависимостей ΔG от температуры.
Из рисунка 1.1 видно, что при Δ H <0 и Δ S >0 процесс протекает самопроизвольно при любых температурах. Напротив, при Δ H >0 и Δ S <0 процесс принципиально неосуществим. Если же знаки Δ H и Δ S совпадают, то реакция может протекать самопроизвольно в некотором интервале температур. Если Δ H =0 (реакция не сопровождается тепловым эффектом), то возможность протекания процесса полностью определяется энтропией. В случае, когда Δ S =0 определяющую роль играет энтальпийный фактор (соблюдается принцип Бертло).
Значение Δ S можно вычислить, пользуясь справочником, где приведены стандартные энтропии многих веществ (см. также таблицу 1 приложения).
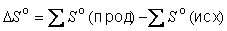
Знак Δ S можно легко определить, не пользуясь справочником, если неупорядоченность системы резко изменяется в ходе реакции:
CaCO3(т) → CaO(т) + CO2(г)
В продуктах реакции имеется газообразное вещество, а исходное вещество твердое, поэтому энтропия продуктов выше, чем исходных веществ. Следовательно, Δ S >0.
Существует также способ расчета Δ G ° реакции через энергии Гиббса образования веществ 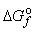 , приводимые в справочниках (см. таблицу 1 приложения):
, приводимые в справочниках (см. таблицу 1 приложения):
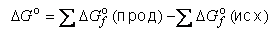
Полагается, что для простых веществ 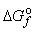 = 0.
= 0.
Изобарно-изотермический потенциал (энергия Гиббса)
Из рассмотренного ранее следует, что в химических процессах одновременно действуют две тенденции:
Стремление частиц объединиться в более сложные, что уменьшает энтальпию.
Стремление частиц разъединиться, увеличить беспорядок, что увеличивает энтропию.
Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянной температуре и постоянном давлении, отражает изменение изобарно-изотермического (или для краткости - изобарного) потенциала ΔG:
ΔG = ΔН – TΔS,
где ΔН - изменение эптальпии (теплосодержания системы), кДж/моль;
ΔS - изменение энтропии (меры беспорядка систем), Дж/моль•К;
T - температура, К.
Изобарный потенциал измеряется в ккал/моль или кДж/моль.
Характер изменений ΔG позволяет судить о принципиальной возможности или невозможности протекания процесса:
Если ΔG < 0, т. е. изобарный потенциал в ходе реакции уменьшается, то процесс возможен и, начавшись, он протекает самопроизвольно (спонтанно).
Если ΔG > 0, то невозможно осуществить процесс в данных условиях.
Если ΔG = 0, наблюдается состояние химического равновесия.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Измерение потенциалов
Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродные потенциалы, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю (для водных систем).
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста
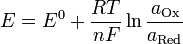 ,
,
где
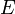 — электродный потенциал,
— электродный потенциал, 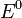 — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
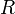 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
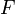 — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
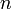 — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;
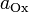 и
и 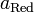 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант 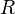 и
и 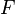 и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при 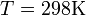 получим
получим
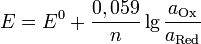
 2015-08-12
2015-08-12 2252
2252
 —
— 






