При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции).
Системой в химии принято называть рассматриваемое вещество или совокупность веществ. При этом системе противопоставляется внешняя среда — вещества, окружающие систему. Обычно система отграничена от среды.
Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы. Гетерогенной — система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства системы изменяются скачком.
Примером гомогенной системы может служить любая газовая смесь (все газы при не очень высоких давлениях неограниченно растворяются друг в друге), хотя бы смесь азота с кислородом.
Другим примером гомогенной системы может служить раствор хлорида натрия, сульфата магния, азота и кислорода в воде. В каждом из этих двух случаев система состоит только из одной фазы: из газовой фазы в первом примере и из водного раствора во втором.
Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Например, при сливании (и перемешивании) растворов серной кислоты и тиосульфата натрия помутнение, вызываемое появлением серы, наблюдается во всем объеме раствора:
¯+SH2SO4+Na2S2O3= Na2SO4+Н2O+SO2
Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Например, растворение металла в кислоте: Fe+2HCl=FeCl2 + H2 может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующих вещества. В связи с этим4скорость гомогенной реакции и скорость гетерогенной реакции определяются различно, Скорость гомогенной реакции определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объёма системы.
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.[1]
Основная статья: Скорость химической реакции
Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
Например для реакции
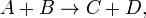 скорость можно выразить так:
скорость можно выразить так:
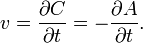
В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
Порядок химической реакции
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Реакция нулевого порядка
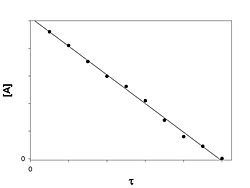

График зависимости концентрации реагента A в реакции A → B от времени для нулевого порядка реакции
Кинетическое уравнение имеет следующий вид:
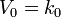
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Реакция первого порядка
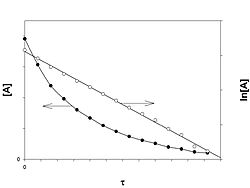

График зависимости концентрации реагента A для первого порядка реакции
Кинетическое уравнение реакции первого порядка:
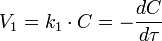
Приведение уравнения к линейному виду даёт уравнение:
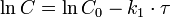
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
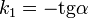
Период полупревращения:
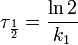
Реакция второго порядка
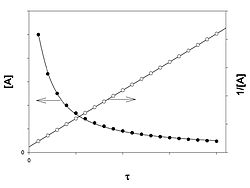

График зависимости концентрации реагента A для второго порядка реакции
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
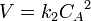
или
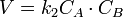
В первом случае скорость реакции определяется уравнением
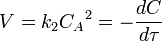
Линейная форма уравнения:
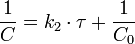
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
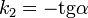
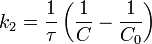
Во втором случае выражение для константы скорости реакции будет выглядеть так:
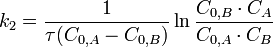
Период полупревращения (для случая равных начальных концентраций!):
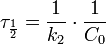
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
Катализ
Основная статья: Катализ
 | Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей. |
Катализ — процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Каталитические реакции — реакции, протекающие в присутствии катализаторов.
Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) — при котором она убывает. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты. Примером отрицательного — снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия.
Многие важнейшие химические производства, такие, как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука, ряда полимеров и др., проводятся в присутствии катализаторов.
Гидролиз (от греч. hydor-вода и lysis - разложение, распад), обменная реакция между веществом и водой. Количественно гидролиз характеризуют константой гидролиза (константой равновесия реакции гидролиза) КГ и степенью 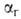 , представляющей собой отношение числа частиц ионов или молекул, подвергшихся гидролизу, к общему числу частиц, введенных в раствор. При
, представляющей собой отношение числа частиц ионов или молекул, подвергшихся гидролизу, к общему числу частиц, введенных в раствор. При 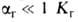 и
и 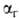 связаны друг с другом как константа и степень ионизации электролита,
связаны друг с другом как константа и степень ионизации электролита, 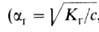 где с-концентрация раствора в моль/л).
где с-концентрация раствора в моль/л).
При гидролизе солей образуются основания и кислоты. В большинстве случаев это обратимая реакция. Необратимо гидролизуются соли, образованные катионом очень слабого основания и (или) анионом очень слабой кислоты, например:
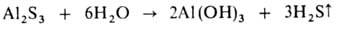
Соли, образованные катионом сильного основания и анионом сильной кислоты (например, LiClO4, NaNO3, KCl), в обычных условиях не гидролизуются и для их водных растворов рН 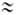 7. Соли, образованные катионом сильного основания и анионом слабой кислоты (например,CH3COONa), гидролизуются по аниону.
7. Соли, образованные катионом сильного основания и анионом слабой кислоты (например,CH3COONa), гидролизуются по аниону.
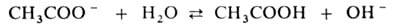
Благодаря образованию ионов ОН водные растворы таких солей имеют щелочную реакцию (рН > 7). Соли слабых многоосновных кислот гидролизуются ступенчато, причем гидролиз по первой ступени всегда преобладает:
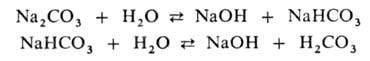
При гидролизе некоторых анионов (WO42-, VO43- и др.) образуются изополианионы (например, W3O102-, V2O74-), молекулярная масса и состав которых зависят от условий реакции.
Соли, образованные катионом слабого основания и анионом сильной кислоты (например, АlСl3), гидролизуются по катиону. В реакции участвует только катион, обычно входящий в состав аквакомплекса.
 Химическое Сырьё! Дёшево! Оптом. Пигменты, Реактивы, Реагенты, Содопродукты и др. Доставка Бесплатно! Скидки! chem-opt.opt.ru Химическое Сырьё! Дёшево! Оптом. Пигменты, Реактивы, Реагенты, Содопродукты и др. Доставка Бесплатно! Скидки! chem-opt.opt.ru |
 Закупаем: кислота glacial acetic acid trade.su Закупаем: кислота glacial acetic acid trade.su |
| Дать объявление | B2BContext |

Вследствие образования гидроксоний-ионов водные растворы таких солей имеют кислую реакцию (рН < 7). Иногда процесс не заканчивается образованием одноядерного аквагидроксокомплекса, а идет дальше с образованием осадка гидроксо- или оксосоли (редко-гидроксида). При комнатной температуре в большинстве случаев гидролиз протекает с образованием остающихся в растворе многоядерных гидроксокомплексов, состав которых, как правило, зависит от условий реакции. Например, в водных растворах, содержащих катионы Fe3+, Be2+, Sn2+, образуются комплексы [Fe2(OH)2]4+, [Веэ(ОН)3]3+, [Sn3(OH)4]2+.
Соли, образованные катионом слабого основания и анионом слабой кислоты, напр. Сu(ООССН3)2, гидролизуются по катиону и по аниону.
Растворы таких солей имеют слабокислую или слабощелочную реакцию в зависимости от того, какой ион гидролизуется в большей степени.
При гидролизе галогенангидридов образуются две кислоты — кислородсодержащая и галогеноводородная; реакция в большинстве случаев идет необратимо:
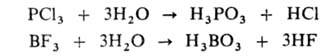
Гидролиз органических соединений широко используется для получения спиртов, альдегидов, кетонов, карбоновых кислот из их производных или галогензамещенных углеводородов, например:
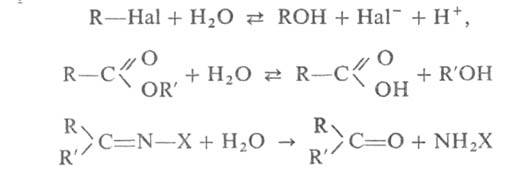
где X = Аг, ОН, NHAr и др.
гидролиз ускоряется в присутствии кислот и оснований, а также ионов металлов, способных прочно связываться с одним из продуктов и смещать тем самым равновесие реакции, например:
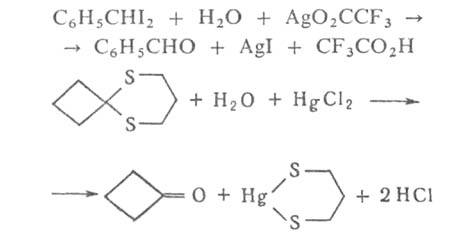
Подбор соответствующих условий и катализаторов позволяет избирательно расщеплять отдельные связи в молекулах, содержащих несколько группировок, способных гидролизоваться, например:
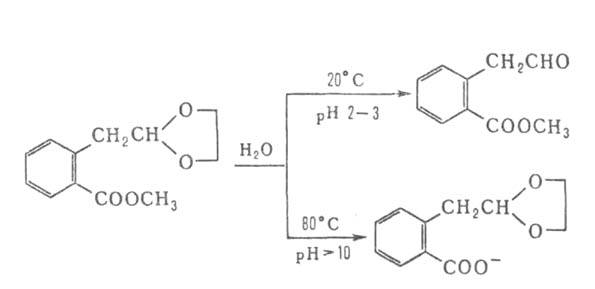
Известна обширная группа ферментов (так называемых гидролаз), катализирующих высокоселективный гидролиз молекул природных соединений. На этих процессах основано большинство методов изучения строения биополимеров.
Гидролиз органических соединений широко используется для получения глюкозы, этилового спирта, карбоновых кислот и других гидролиз жиров - основа промышленного получения мыла и глицерина. Ферментативный гидролиз органических соединений применяется в пищевой, текстильной, фармацевтической промышленности. См. также Гидролизные производства
 2015-08-12
2015-08-12 14733
14733
