· Центрогенная дыхательная недостаточность.
· Нервно-мышечная дыхательная недостаточность.
· Париетальная или торакодиафрагмальная дыхательная
недостаточность.
· Бронхолегочная дыхательная недостаточность:
1) обструктивная;
2) рестриктивная (ограничительная);
3) диффузионная.
Центрогенная ДН возникает при травмах и заболеваниях головного мозга, сдавлении и дислокации его ствола, в раннем периоде после клинической смерти, при некоторых интоксикациях (опиаты, барбитураты и др.), нарушениях афферентной импульсации. Центрогенная ДН может развиваться при тяжелом атеросклерозе сосудов головного мозга или в результате некоторых действий врача (общее обезболивание, местная анестезия слизистых оболочек верхних дыхательных путей)
Нервно-мышечная ДН развивается при расстройствах передачи нервного импульса дыхательным мышцам и нарушении их функций. Она возникает при полиомиелите, полирадикулоневрите, травмах и заболеваниях спинного мозга с поражением передних рогов его шейного и грудного отделов, некоторых экзогенных интоксикациях (отравлениях курареподобными веществами, мускаринами, фосфорорганическими соединениями, при остаточном действии миорелаксантов после общей анестезии и др.), а также при нарушениях сократимости дыхательных мышц: при судорожном синдроме любого происхождения, миастении, синдроме Гийена—Барре и т. д. Кроме того, нервно-мышечная ДН может развиться при тяжелых водно-электролитных нарушениях, особенно при выраженной гипокалиемии, гипокальциемии, гипофосфатемии.
При нервно-мышечной ДН всегда нарушается функция дыхательных мышц, в результате чего в той или иной мере нарушается их способность выполнять работу по обеспечению дыхания.
Характерная черта этой формы ДН — раннее развитие альвеолярной гиповентиляции и гиперкапнии, хотя в начальном периоде в зависимости от этиологии может наблюдаться увеличение минутного объема дыхания (МОД) за счет выраженного тахипноэ при уменьшенном дыхательном объеме (VT). Гиперкапния, сопровождаясь увеличением РАС02, приводит к
снижению РА02 вследствие изменения состава альвеолярного газа. Также рано возникают явления бронхиальной обструкции в связи с нарушением процесса откашливания (см. ниже). Кроме того, гиповентиляция ведет к снижению активности сурфактанта, развитию микроателектазов.
Париетальная, или торакодиафрагмальная, ДН развивается при болевом синдроме, связанном с дыхательными движениями (травма, ранний период после операций на органах грудной клетки и верхнего этажа брюшной полости), нарушении каркасности грудной клетки (множественный "оконча-
тый" перелом ребер по нескольким линиям, обширная торакопластика), сдавлении легкого массивным пневмо-, гемоили гидротораксом, нарушении функции диафрагмы.
При хронической обструктивной болезни легких (ХОБЛ) наступает динамическая гиперинфляция легких, связанная с нарушением выдоха. При этом размер легких увеличивается, диафрагма оттесняется книзу и уплощается. Последнее сопровождается укорочением ее мышечных волокон и нарушением их функции, снижением объема вдоха. Во всех этих случаях значительно уменьшается VT, и компенсация до определенного предела осуществляется за счет учащения дыхания. Так же как и при нервно-мышечной ДН происходит расстройство кашлевого механизма, декомпенсация быстро приводит к альвеолярной гиповентиляции и развитию гиперкапнии. Кроме того, гиповентиляция легкого или его долей обусловливает развитие ателектазов и воспалительных процессов (см. ниже).
Бронхолегочная (паренхиматозная) ДН. С этой формой дыхательной недостаточности, в первую очередь острой, анестезиологу и реаниматологу приходится иметь дело, пожалуй чаще всего. Стоит отметить, что при всех остальных формах ОДН нарушения функций легких и дыхательных путей обязательно присутствуют и играют весьма важную роль, особенно в далеко зашедших стадиях. В конечном счете патогенетические механизмы, приводящие к гипоксемии (а затем и к гиперкапнии), при бронхолегочной ОДН заключаются в первую очередь в нарушении вентиляционно-перфузионных отношений. Как известно, в норме перфузия кровью происходит в тех участках легких, которые в это время вентилируются (рефлексфон Эйлера). Именно в этих участках и осуществляется газообмен между альвеолярным воздухом и кровью легочных капилляров (рис. 1.2, а). У здорового человека вентиляционно-перфузионное отношение равно 0,8—0,83. Не вентилируемые в данный момент участки легких находятся в состоянии "физиологического ателектаза", перфузии в них нет. Если эти участки начинают вентилироваться (например, при физической нагрузке), легочный кровоток перераспределяется и перфузия захватывает и эти зоны. При ряде патологических процессов это соответствие нарушается и тогда в легких возникают три зоны (рис. 1.2, б). В первой, где имеются и вентиляция, и перфузия, происходит газообмен.
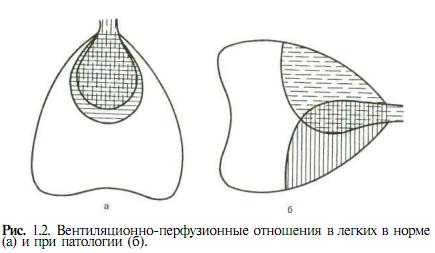
Во второй (пунк-тирная штриховка) альвеолы вентилируются, но нет перфу
зии, а следовательно, и газообмена. Эта зона входит в объем физиологического мертвого пространства (VD) и значительно увеличивает его. Для вентиляции важна не столько сама величина VD, сколько отношение объема мертвого пространства к дыхательному объему (VT). В норме отношение VD/VT не превышает 0,3—0,4, т. е. 60—70 % вдыхаемого за один вдох воздуха участвует в газообмене и 30—40 % остается в мертвом про
странстве. Увеличение VD/VT означает, что организм в большей мере расходует энергию на вентиляцию мертвого пространства и в меньшей — на альвеолярную вентиляцию. В качестве компенсаторной реакции происходит увеличение МОД сначала за счет повышения VT (если это возможно), а затем за счет увеличения частоты дыхания. При этом возрастают энергетические затраты на дыхание.
Еще большую опасность представляет третья зона (сплошная вертикальная штриховка), где есть кровоток, но нет вентиляции и соответственно газообмена. Притекающая в эту зону венозная кровь оттекает из нее неартериализованной. Смешиваясь с кровью, оттекающей от вентилируемых участков, она создает венозное примешивание к артериальной крови, т. е. увеличивает шунт справа налево. В норме этот шунт не превышает 7 % от объема кровотока. При увеличении шунта развивается гипоксемия, которую организм не может компенсировать повышением работы дыхания. В начальных стадиях ОДН, как уже упоминалось, гипоксемия сочетается с гипо-
капнией за счет усиленной вентиляции тех участков легких, где происходит газообмен.
Различают обструктивную и рестриктивную (ограничительную) бронхолегочную ДН. "В чистом виде" они развиваются достаточно редко, как правило, приходится иметь дело со смешанными формами, при которых может превалировать тот или другой процесс.
1. Обструктивная ДН. Возникает при нарушениях проходимости дыхательных путей: верхних (западение языка, попадание инородного тела в гортань или трахею, отек гортани, выраженный ларингоспазм, гематома, опухоль, странгуляция и др.) и нижних, т. е. бронхов (ХОБЛ, бронхоспазм, бронхо-
рея, нарушения откашливания, преждевременное закрытие дыхательных путей и др.). Хроническая обструктивная ДН характеризуется изменением паттернов дыхания, в первую очередь — структуры дыхательного цикла. При ДН, вызванной обструкцией бронхов, происходит нарушение фазы выдоха, при нормальной ее длительности часть выдыхаемого воздуха не успевает покинуть легкие, возникает их динамическая гиперинфляция. В результате давление в легких в конце выдоха не сравнивается с атмосферным, т. е. возникает внутреннее положительное давление в конце выдоха.
2. Рестриктивная ДН. В острой форме возникает при травме и заболеваниях легких, после обширных резекций и т. д. и сопровождается снижением эластичности легких, следовательно, каждый вдох требует значительного
повышения работы дыхания. Причинами развития этой формы ОДН могут быть пневмонии, обширные ателектазы, нагноительные заболевания, гематомы, пневмониты. Своеобразным процессом, вызывающим тяжелую ОДН, является острый респираторный дистресс-синдром. При рестриктивной ХДН происходит деградация коллагеновых структур легких, в результате их эластичность снижается. Это является второй причиной развития динамической гиперинфляции легких (первая — нарушение бронхиальной
проходимости, см. выше). При этом функциональная остаточная емкость (ФОЕ) легких может возрасти до величины их общей емкости. Легкие
становятся "гипервоздушны", их объем резко увеличивается, они смещают диафрагму вниз, что приводит к нарушению ее функции. В связи с увеличением объема грудной клетки за счет ее переднезаднего размера ("бочкообразная грудная клетка") наружные межреберные мышцы укорачиваются и их функция также нарушается. Одной из причин декомпенсации рестриктивной ХДН является утомление дыхательных мышц, в первую очередь — диафрагмы. Критерием нормальной или сниженной функции инспираторных мышц является отношение между отрицательным давлением, которое развивает больной во время нормального вдоха (Рi) из открытой маски и максимальным инспираторным давлением, которое он способен развить во время попытки вдоха из закрытой маски (MIP или mРi). Отношение Рi/МIР в норме равно примерно 0,05. Увеличение этого отношения (за счет снижения MIP) до 0,4 и выше свидетельствует об утомлении мышц вдоха. Выделяют также более тяжелое состояние — усталость дыхательных мышц. Для его характеристики предложен индекс
напряжение-время (tension-time index) — TTI.
4. Диффузионная ДН. Стоит напомнить, что в норме диффузия газов происходит через альвеолярно-капиллярную мембрану, толщина которой вместе с пристеночным слоем плазмы составляет 0,7—0,9 мкм, со скоростью 25 (мл/мин) х мм рт.ст.1. Следует также отметить, что в газообмене участвуют не только легочные капилляры, но и артериолы и даже мелкие артерии малого круга кровообращения (феномен внекапиллярной диффузии). Подобный механизм существует также в головном мозге.
Нарушения лимфооттока от легких.
Как известно, стенки лимфатических капилляров построены из одного слоя эндотелиальных клеток, которые при помощи пучков тончайших волоконец — филаментов прикреплены к рядом лежащим пучкам коллагеновых волокон. Такая тесная связь коллагеновых волокон и стенок лимфатических капилляров способствует раскрытию просвета последних. Глубокие лимфатические сосуды располагаются преимущественно вокруг венозных сосудов, а также в стенке бронхов и перибронхиальных муфтах. В межальвеолярных промежутках лимфа представляет собой нечто вроде выпота, и ее движение до начала бронхиол происходит не по лимфатическим сосудам в прямом смысле этого термина, а по относительно свободным пространствам интерстиция между плотными соединительнотканными структурами. Альвеолярные перегородки лишены лимфатических капилляров. Последние начинаются на уровне терминальных бронхиол, а также в межацинозной и междольковой соединительной ткани и в адвентиции кровеносных сосудов. Лимфатические сосуды — основная дренажная система легких — выводят воду и белки, поступившие в легочный интерстиций из кровеносных капилляров. Присутствие в лимфатических сосудах гладких мышечных волокон и функционирование некоторых других механизмов (например, в легких лимфатические посткапилляры содержат клапаны) позволяет поддерживать в лимфатических путях давление, достигающее 2,5 см вод.ст, и способствующее транспорту по ним жидкости.
Дыхательные движения легкого также ускоряют лимфоток. Обструкция лимфатических путей вне зависимости от природы может вызвать интерстициальный отек легких. К состояниям, которые чаще всего вызывают отек легких из-за нарушения лимфатического дренирования, относят длительное повышение внутригрудного и системного венозного давления.
В норме лимфоотток от легких составляет всего несколько миллилитров в час (около 20), однако при длительном повышении давления в легочных капиллярах он значительно увеличивается. Стабильность лимфооттока определяется перфузией бронхиальных сосудов. При увеличении проницаемости или разрушении альвеолярных мембран усиливается выход через них воды и белка.Одной из причин этих нарушений может быть трансфузия донорской крови, особенно больших сроков хранения. При нор
мальной функции лимфатической системы интерстиций легких легко разгружается за счет лимфатического дренажа, но если последний нарушен, возникает интерстициальный отек легких.
Нарушения в системе бронхиального кровообращения.
Защитные функции дыхательных путей, жидкостный баланс и метаболические функции легких зависят от бронхиального кровообращения. Бронхиальные сосуды могут увеличиваться в диаметре в ответ на травму и даже принять на себя функцию газообмена, если в любом регионе перестает функционировать кровоток по системе легочной артерии. Бронхиальные артерии (обычно существуют две для каждого легкого) берут начало непосредственно от аорты или от межреберных артерий. Они входят в корень легкого, достигают бифуркации трахеи, спускаются по левому и правому главным бронхам, огибают их и делятся по ходу более мелких бронхов. Эти ветви широко анастомозируют, формируя перибронхиальные сплетения и кровоснабжают стенки бронхов, включая мышечную стенку. Выше уровня терминальных бронхиол они сливаются с сосудами системы легочной арте
рии. Кровь из бронхиальных вен поступает в основном в левое предсердие, формируя анатомический шунт. Основная функция бронхиальных артерий — трофическая, направленная на снабжение дыхательных путей и тканей легкого кислородом и другими компонентами артериальной крови, необходимыми для адекватного метаболизма в этом регионе. Венозный отдел бронхиальной кровеносной системы выполняет наряду с лимфатическими сосудами дренажную функцию, причем отмечена тесная корреляция между интенсивностью бронхиального кровотока и легочным лимфогенезом. Между легочным и бронхиальным кровотоком существуют анастомозы, в норме кровь поступает из бронхиальных артерий (где давление выше) в легочные сосуды. В патологических условиях через эти анастомозы может осуществляться шунтирование венозной крови в артериальное русло (так на
зываемый "бронхиально-пульмонарный кровоток"). Системная артериальная гипоксемия и гиперкапния увеличивают как анастомотический, так и общий бронхиальный кровоток. Усиление взаимовлияний бронхиальной и легочной гемодинамики происходит при стойких патологических повышениях давления в малом круге кровообращения, в частности, при эмфиземе легких, пневмосклерозе, митральном стенозе острой пневмонии, легочной венозной окклюзии. Считается возможным увеличение бронхиального кровотока при гипоксической вазоконстрикции сосудов малого круга. Существенное увеличение коллатерального альвеолярного кровотока зафиксировано при окклюзии ветвей легочной артерии. Поражение легочного кровообращения. Первичное нарушение легочного кровообращения может возникать при тромбоэмболии ветвей легочной артерии, жировой эмболии, эмболии околоплодными водами, сепсисе, гипоксической гипоксии (вследствие гипоксической вазоконстрикции), анафилактическом шоке и остром респираторном дистресс-синдроме. К выраженной легочной гипертензии, в результате которой развивается альвеолярный отек легких, приводит также острая левожелудочковая недостаточность. При рассыпной тромбоэмболии достаточно крупных ветвей легочной артерии наряду с выраженной гипоксемией быстро возникает гиперкапния, по-видимому, в результате резкого увеличения отношения VD/VT.
Нарушения метаболических функций легких.
При всех видах дыхательной недостаточности, особенно при ОДН, происхо
дит нарушение метаболических (недыхательных) функций легких. Как известно, к этим функциям относятся синтез и секреция поверхностно-активных веществ — сурфактантов участие в регуляции свертывающей и противосвертывающей систем крови; участие в регуляции гемодинамики, в частности через метаболизм биологически активных веществ (кинины простагландины, катехоламины, серотонин, гистамин, цитокины и др.); участие в белковом, углеводном, жировом обмене (биосинтез аминокислот, липидов, АТФ, метаболизм молочной и пировиноградной кислот, продукция лактата и т.д) частие в иммунитете (захват и секреция в кровеносное русло
иммуноглобулинов). Значимым аспектом обмена белков в легких является синтез коллагена, который играет важную роль в развитии интерстициального фиброза легких. Функции сурфактантной системы нарушаются при различных патологических процессах в легких, в том числе при острых респираторных инфекциях, пневмониях, остром респираторном дистресс-синдроме. Могут быть нарушены как содержание сурфактантов в альвеолярной жидкости, так и их свой ства, в результате чего повышается поверхностное натяжение в альвеолах и возникают необтурационные ателектазы. Легкие в норме могут инактивировать лишь незначительное количество гистамина, поступающего в них со смешанной венозной кровью. При паренхиматозной дыхательной недостаточности эта способность практически сводится на нет. Вследствие этого происходит сочетанный выброс из легких в кровь неинактивированного гистамина, гепарина и протеолитических ферментов, что активно влияет на увеличение проницаемости клеточных мембран и развитие отека внесосудистого пространства в легких. В отличие от гистамина легкие инактивируют 95 % проходящего через них серотонина. Нарушение серотонинин-активирующего механизма усиливает процесс образования фибробластов и способствует развитию интерстициального фиброза. Повышенное содержание серотонина оказывает выраженное влияние на гемо- и лимфодинамику малого круга кро
вообращения, участвует в развитии патологических реакций легких на гипоксию, гиперкапнию, кровопотерю. Серотонин также усиливает агрегацию тромбоцитов и повышает склонность к тромбообразованию, является активным вазоконстриктором для легочных артериол и вен и, таким образом принимает участие в формировании легочной гипертензии и некардиогенного отека легких. При паренхиматозной дыхательной недостаточности происходит нарушение синтеза в легких катехоламинов, кининов и простагландинов. Возможно, этим объясняются нарушения гемодинамики, часто возникающие при острых воспалительных поражениях легких.
 2015-08-13
2015-08-13 2246
2246
