Метод фіксування потенціалу дає змогу безпосередньо реєструвати іонні струми, що протікають через мембрану за заданого рівня мембранного потенціалу. Уперше його застосував К. Коул (1949), а потім - і А. Ходжкін, А. Хакслі й Б. Катц (1952). Метод полягає в тому, що мембранний потенціал на обмеженій ділянці мембрани майже митгєво змішують до деякого нового значення й утримують його на цьому рівні за допомогою електронної схеми зі зворотним зв'язком. Струм, що протікає через цю ділянку, вимірюють окремим підсилювачем. У класичній серії експериментів Ходжкін, Хакслі й Катц виміряли кінетику змін іонної проникності мембрани гігантського аксона кальмара прямим методом фіксування потенціалу. Метод дає змогу контролювати мембранний потенціал, здійснюючи "прямокутні" зміни мембранного потенціалу з одночасною безпосередньою реєстрацією електричного струму, що протікає крізь мембрану. Зареєстрований струм може бути розділено на індивідуальні іонні компоненти, що надає безпосередню інформацію про активність окремих типів іонних каналів.
Використовуючи метод фіксування потенціалу, всі ділянки всередині гігантського аксона кальмара з'єднували металевим електродом, що забезпечувало їх ізопотенціальність (рис. 9.6, а). У цьому разі можна розглядати нерв як ізольований відрізок мембрани.
На рис. 9.6, б наведено схему фіксування напруги на сферичній клітині, а на рис. 9.6. в і г - схему фіксування напруги за допомогою методу "петч клемп" (англ. patch clamp) з відведенням від цілої клітини (в) і від фрагмента плазматичної мембрани (г).
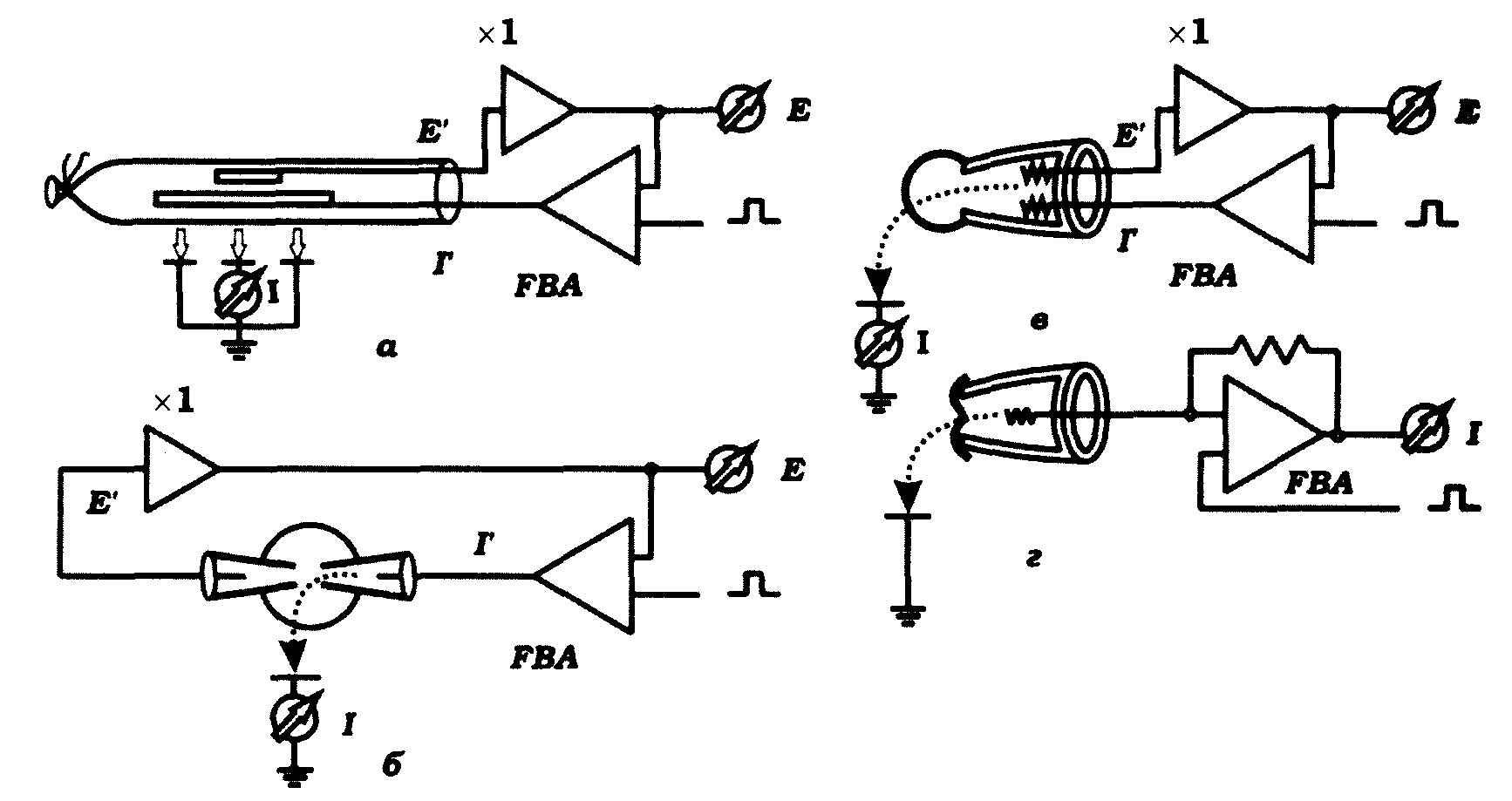
Рис. 9.6. Різноманітність методу фіксування потенціалу (Б. Хілле, 1984):
а - фіксування потенціалу на гігантському аксоні кальмара: Е - електрод для вимірювання мембранного потенціалу, сполучений із входом попереднього підсилювача з коефіцієнтом підсилення, що дорівнює 1; Е - пристрій для вимірювання мембранного потенціалу;
І’ - електрод для пропускання крізь мембрану електричного струму;
І - пристрій для вимірювання струму крізь мембрану; FВА – підсилювач зворотного зв'язку, що здійснює фіксування потенціалу на мембрані аксона;
б - фіксування потенціалу на сферичних клітинах з використанням двох скляних внутрішньоклітинних електродів;
в - фіксування потенціалу на ізольованій клітині з використанням скляної піпетки, що утворює щільний контакт з мембраною;
г - фіксування потенціалу на мікрофрагменті мембрани ("петч клемп") з використанням мікропіпеткн, що утворює щільний контакт із фрагментом мембрани (гігаомннй контакт)
Метод фіксування потенціалу дає змогу змінювати мембранний потенціал за кілька мікросекунд, а потім утримувати його на новому постійному рівні. І як наслідок - струм тече через ємність лише впродовж дуже короткого часу. За досягнення стаціонарного рівня потенціалу весь струм, що протікає через мембрану, переноситься іонами, що проходять по іонних каналах.
Результати, отримані Ходжкіним і Хакслі (1952) на гігантському аксоні кальмара, показали, що в разі деполяризації мембрани натрієві й калієві канали поводяться по-різному. Провідність мембрани для іонів натрію підвищується достатньо швидко, досягає максимуму, а потім знижується практично до нуля в міру того, як відбувається інактивація. Провідність мембрани для іонів калію збільшується повільніше й не знижується за досить тривало утримуваної деполяризації.
Поведінку натрієвих каналів зумовлено наявністю двох ворітних процесів: активації, що контролює швидкість і потенціалзалежність підвищення проникності Nа+ під час деполяризації, та інактивації, що контролює наступне зменшення проникності Nа+ за утримуваній деполяризації.
На рис. 9.8 показано іонні струми й зміну провідності при зміні мембранного потенціалу в гігантському аксоні кальмара за умови фіксування потенціалу.
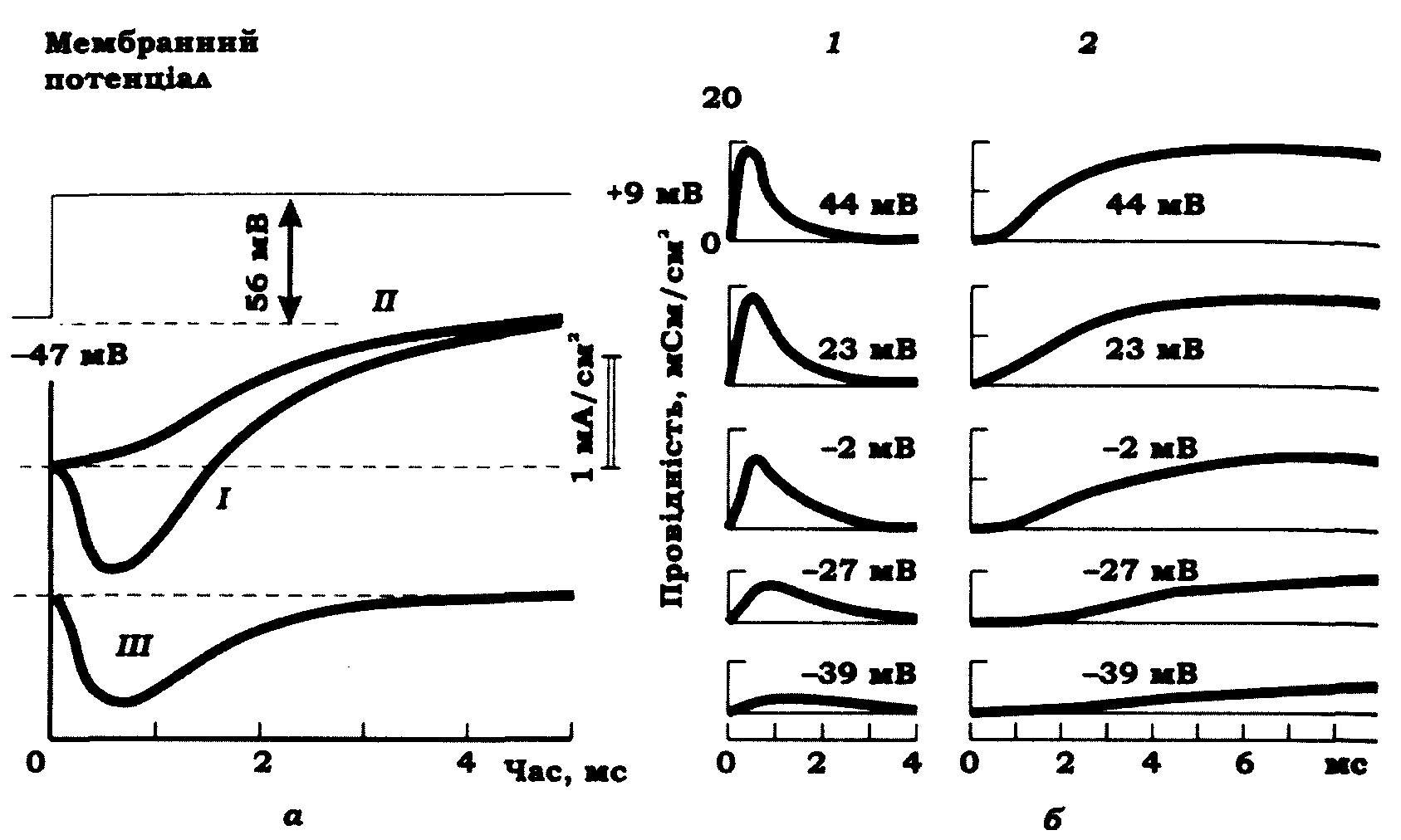
Рис. 9.8. Іонні струми при фіксуванні потенціалу на аксоні кальмара (а) і характер змій провідності мембрани для іонів натрію 1 і калію 2 за різних рівнів фіксованого мембранного потенціалу (б) (А. Ходжкін, А. Хакслі, 1952):
а: І - іонний струм, зареєстрований при фіксуванні потенціалу на рівні +9 мВ у нормальному сольовому розчині; II- іонний струм, зареєстрований у безнатрієвому розчині, що був ідентифікований як калієвий струм; III - крива натрієвого струму, отримана шляхом вилучення з кривої І кривої II;
б - зміни провідності мембрани для іонів натрію 1 і калію 2 за різних рівнів фіксованого потенціалу, що зазначені на рисунку
Одним з найважливіших факторів, що визначає електричну збудливість, є здатність Nа+-каналів активуватись у відповідь на деполяризацію. Фракція Nа+-каналів, здатних активуватися, визначається двома окремими процесами інактивації - швидким і повільним. Вони пов'язані з різними механізмами. Швидка інактивація відіграє суттєву роль в обмеженні тривалості потенціалу дії, визначаючи частоту генерації потенціалів дії й регулюючи збудливість. Молекулярні механізми швидкої інактивації деякою мірою з'ясовано й визначено можливості фармакологічних впливів на цей процес. Повільна інактивація також має певне значення в різних виявах електричної активності. Молекулярні механізми повільної інактивації майже невідомі. Існує припущення, що швидка інактивація знижує ймовірність подальшої повільної інактивації.
На рис. 9.9 наведено вольт-амперні характеристики для натрієвого й калієвого струмів. Точка перетину вольт-амперної характеристики для натрієвого струму з віссю абсцис відповідає мембранному потенціалу, що дещо нижче рівноважного потенціалу для іонів натрію. Це відхилення пов'язане з тим, що активація натрієвої провідності мембрани відбувається за наявності інших струм через мембрану по калієвих каналах і каналах витоку.
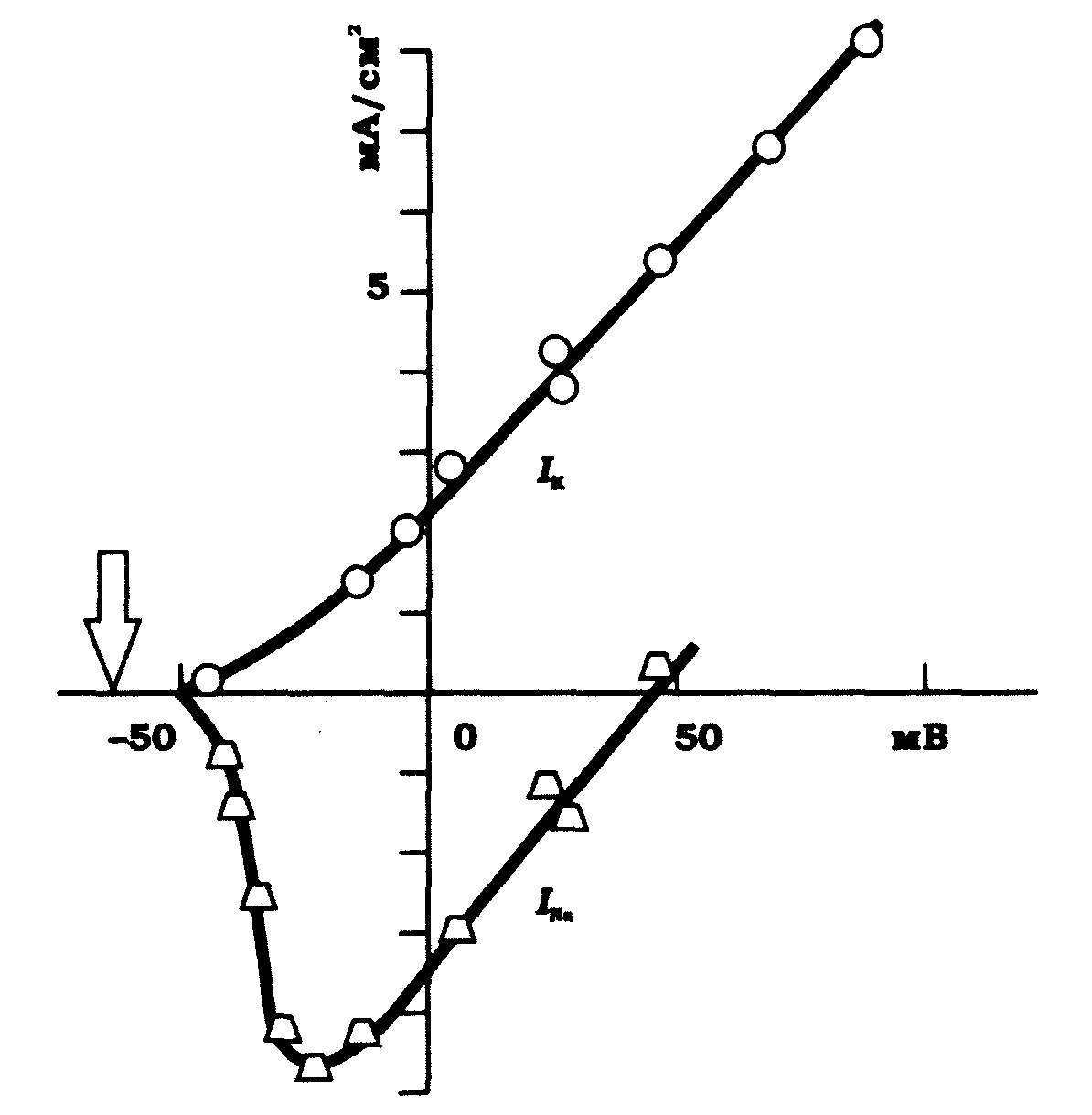
Рис. 9.9. Вольт-амперні характеристики для натрієвого INa ікалієвого IK струмів. Стрілкою позначено вихідний рівень мембранного потенціалу (А. Ходккін, 1966)
Під час вивчення роботи іонних каналів за умов фіксування потенціалів нерідко виникає необхідність уведення у клітину речовин, що взаємодіють з іонними каналами, а також змін іонного складу внутрішньоклітинного середовища. Було запропоновано метод внутрішньоклітинної перфузії гігантського аксона кальмара (П. Бейкер, Т. Шоу, А. Ходжкін, Т. Ойкава, С. Спиропулус, І. Тасакі, Т. Теорелл), який полягає у видаленні аксоплазми й заміщенні її розчином заданого складу. Перфузований гігантський аксон кальмара зберігає електричну збудливість і генерує потенціали дії. При цьому з аксона кальмара видаляють значну частину аксоплазми й заповнюють його сольовим розчином. За таких умов аксон може генерувати понад 100 000 імпульсів. Аналогічні експерименти з використанням техніки діалізу, а також на виділених фрагментах плазматичної мембрани багатьох збудливих клітин дали подібні результати.
Відкривання та закривання іонних каналів зумовлено конформаційними змінами канального білка, що є результатом дії електричного поля або лігандів. Безпосередньо це не потребує витрат енергії метаболізму, що підтверджують досліди на перфузованих клітинах і досліди з умонтування ізольованих іонних каналів у штучні бішарові ліпідні мембрани.
На перфузованому аксоні успішно здійснено фіксування потенціалів. Було підтверджено висловлені раніше припущення про механізми виникнення потенціалу спокою й потенціалу дії. Розробку внутрішньоклітинної перфузії згодом було продовжено й на інших гігантських нервових і м'язових волокнах безхребетних тварин.
При вивченні властивостей іонних каналів мембрани тіла (соми) нервової клітини також широко використовують метод фіксування потенціалів. Особливо зручними для такого роду досліджень є гігантські уніполярні нейрони молюсків. Форма тіла цих нейронів наближається до сферичної (її діаметр досягає 200-800 мкм), від тіла відходить один відросток. У тіло нейрона вводять кінчики двох мікроелектродів. Один з яких використовують для вимірювання мембранного потенціалу, другий - для пропускання струму (рис. 9.6, б). При фіксуванні потенціалу на таких нейронах нерідко спостерігається активність неконтрольованих ділянок аксона, що приводить до деякої помилки в оцінці іонних струмів. У зв'язку із цим експерименти стали проводити на ізольованому тілі нейрона (П. Костюк, О. Кришталь, В. Підоплічко). Ізоляція здійснювалася після дії на препарат протеолітичних ферментів.
Реєстрація струмів поодиноких іонних каналів. Останнім часом широко використовують метод фіксування потенціалів на мікрофрагменті клітинної мембрани ("петч клемп"). Він дає змогу реєструвати струми поодиноких іонних каналів. Перші такі реєстрації було здійснено Е. Неєром і Б. Сакманом у 1976 р. Основою для створення методу було встановлення того факту, що за певних умов клітинна мембрана формує надзвичайно щільний контакт з кінчиком скляної мікропшетки (гігаомний контакт). Унаслідок цього утворюється електричне ізольована ділянка мембрани. Для методу "петч клемп" використовують ферментативно дисперговані клітини або ж клітинні культури. Схему фіксування потенціалу на мікрофрагменті мембрани наведено на рис. 9.6, г.
За допомогою методу Е. Неєра й Б. Сакмана стало можливим досліджувати клітини, що мають діаметр 2-5 мкм, тоді як раніше ефективне фіксування напруги здійснювали на клітинах, розмір яких перевищував 50 мкм. Метод "петч клемп" дає змогу вивчати біофізичні властивості найрізноманітніших клітин, зокрема нейронів мозку ссавців.
 2015-08-13
2015-08-13 1141
1141







