1.Рассчитанный по уравнению Нернста равновесный потенциал зависит от концентраций окисленной и восстановленной форм рассматриваемой полуреакции: увеличение концентрации окисленной формы, также как уменьшение концентрации восстановленной формы, приводит к возрастанию потенциала. Однако эти изменения потенциала сравнительно невелики. Например для n=1 увеличение концентрации окисленной формы в 1000 раз приводит к изменению потенциала на (0,059/n) lg 1000 ≈ 0,188В.
Во многих окислительно-восстановительных реакциях участвуют ионы водорода (гидроксония)
Cr2O72- +14H+ + 6e- = 2Cr3+ + 7H2O.
Для полуреакции в общем виде имеем:
aОx + zH+ + ne- = bRed + ½ zH2O.
В соответствии с уравнением Нернста потенциал выражается следующим образом:
Е= Е° +(0,059/n)lg([Оx]a[H+]z/[Red]b).
2.Значение рН среды иногда определяет возможность осуществления окислительно-восстановительной реакции и использование ее в аналитической химии. Например, в зависимости от кислотности раствора реальный потенциал восстановления перманганата принимает следующие значения: рН =0, Е=1,51 В; рН=3, Е=1,23 В; рН=6, Е=0,93 В. Учитывая это, можно использовать перманганат калия для дифференцированного окисления следующих окислительно-восстановительных систем: Е°Сl2/2Cl- = 1,36 В; Е°Br2/2Br- = 1,09 В; Е°I2/2I- =0,54 В. При рН =6 окисляется только I-, при рН=3 – I- и Br-, тогда как при рН=0 окислить можно все три иона.
3.На значение потенциала существенное влияние оказывают реакции комплексообразования, при которых возможно существование в растворе ряда комплексных соединений. Обычно наиболее склонна к реакциям комплексообразования окисленная форма, в результате чего потенциал системы и окислительные свойства уменьшаются. Эту зависимость потенциала от концентрации комплесообразующего реагента
широко используют в аналитической практике для регулирования окислительно-восстановительных свойств различных систем. Например, при титровании раствора, содержащего ионы Fe2+, раствором бихромата калия в присутствии дифениламина комплексообразование используется для снижения индикаторной ошибки.
3.Как следует из уравнения Нернста, потенциал системы зависит от температуры (предлогарифмический множитель). Наиболее существенно влияние температуры на потенциал окислительно-восстановительных систем, включающих гетерогенную фазу. Кроме того, значительное влияние температура оказывает на скорость окислительно-восстановительных реакций.
4.Ионная сила. Если конкурирующих реакций нет, то Е' зависит только от ионной силы раствора, если же имеют место конкурирующие реакции, то при рассчете E' следует учитывать только а, так как воздействие конкурирующих реакций на величину Е' во много раз превышает воздействие ионной силы раствора.
5.Осаждение. Иноrда одна из форм (или обе) малорастворима.
Если обе формы твердые соединения, то потенциал есть функция концентрации иона. Например, в системе, состоящей из металлическоro серебра, покрытоrо хлоридом серебра и поrpуженноrо в раствор хлорида, про-
текает полуреакция.Образование малорастворимоrо соединения с участием окисленной формы понижает, а с участием восстановленной формы _ повышает стандартный потенциал системы.
Вычисление реальных (формальных) потенциалов.(конкурирующие реакции) В реальной системе,когда а< 1, y<1, т.е. имеют место конкурирующие реакции и межионные взаимодействия.
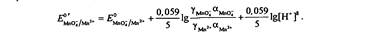
Формальный потенциал зависит от ионной силы раствора и от глубины конкурирующих реакций.
Если конкурирующих реакций нет, то Е' зависит только от ионной силы раствора, если же имеют место конкурирующие реакции, то при рассчете E' следует учитывать только а, так как воздействие конкурирующих реакций на величину Е' во много раз превышает воздействие ионной силы раствора.
 2015-08-13
2015-08-13 8861
8861
