Если один из электродов- СВЭ, то выражение для ЭДС гальванического элемента выражается уравнением Нернста. Уравнение Нернста выражает зависимость потенциала пары от активностей ее компонентов.
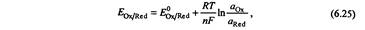
Активности компонентов следует возвести в степени равные стехиометрическим коэффициентам.
Часто постоянные величины объединяют в одну константу, а натуральный логарифм заменяют десятичным. Тогда при 25° С
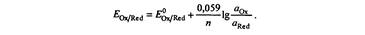
Стандартный электродный потенциал — это равновесный потенциал полуреакции при активностях всех участвующих в равновесии частиц, равных 1 М.
Стандартный потенциал зависит только от температуры, давления и природы растворителя.
На практике удобнее пользоваться концентрациями, а не активностями.
В этом случае уравнение Нернста можно переписать используя общие концентрации окисленной и восстановленной форм сох и cRed. Поскольку а =уас, то уравнение Нернста приобретает вид: 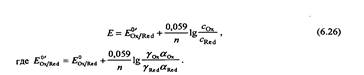
Формальный (реальный) потенциал равен равновесному потенциалу при общих концентрациях окисленной и восстановленной форм, равных 1 М, и заданных концентрациях всех других веществ, присутствующих в системе. Это потенциал данной пары при равенстве аналитических концетрации ее компонентов.
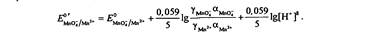
Формальный потенциал, в отличие от стандартного, зависит от ионной силы, глубины протекания конкурирующих реакций и концентраций частиц, не являющихся окисленной либо восстановленной формами но принимающих участие в полуреакции (в данном примере — Н+).
 2015-08-13
2015-08-13 2357
2357







