Данный метод применяется в случае, если в справочной таблице не окажется числового значения плотности, соответствующего приготовленному раствору. Для расчета используют значения, ближайшие по величине к приготовленному раствору: строится график  r = f(w %), значения r и w % необходимо взять из таблицы 2 и 3. Затем, используя полученное значение r х пографику определяем значение w х%.
r = f(w %), значения r и w % необходимо взять из таблицы 2 и 3. Затем, используя полученное значение r х пографику определяем значение w х%.
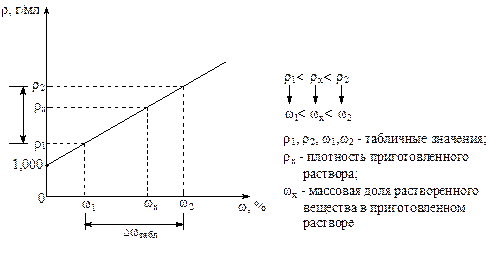
1) Drтабл. = r2 - r1
2) Dwтабл. = w2 - w1
3) Drх = r2 - rх
4) Dwх можно найти из пропорции:
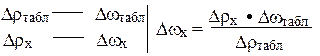
5) Dwх = w2 - wх Þ wх = w2 - Dwх
Литература.
1. Д.А. Князев, С.Н. Смарыгин. Неорганическая химия. – М.: Высшая школа, 2005.
2. Н.Л. Глинка. Общая химия. – М.: Интеграл – Пресс, 2001.
3. Н.Л. Глинка. Задачи и упражнения по общей химии. – М.: Интеграл – Пресс, 2004.
Лабораторная работа № 3
Теория электролитической диссоциации.
Цель работы: изучение химических свойств различных видов электролитов в водных растворах.
Задачи: 1) рассмотреть реакции электролитов в свете теории электролитической диссоциации; 2) отметить особенности поведения амфотерных электролитов.
Реактивы и оборудование: 1) 2н. растворы HCl, CH3COOH, NaOH или КОН, 2) 0,5н растворы NaCl, CaCl2, NH4Cl, ZnSO4 или ZnCl2, или Zn(NO3)2, KClO3, 3) 0,1н раствор AgNO3, 4) металлический цинк, 5) штативы с пробирками, 6) пробиркодержатель, 7) водяная баня, 8) пинцет.
Взаимодействие между молекулами и ионами растворяемого вещества и молекулами растворителя (сольватация) имеет сложный характер и состоит из нескольких стадий, которые протекают одновременно или последовательно: молекулярная диссоциация, образование сольватов, ионизация и электролитическая диссоциация. В зависимости от типа растворяющихся веществ число стадий может изменяться.
В случае растворов неэлектролитов процесс сольватации останавливается на стадии образования сольватированной молекулы:
АВ + (n+m)S «AB(n+m)S,
где (n+m)S – (n+m) молекул растворителя S.
Поэтому в растворе отсутствуют ионы, и раствор не обладает ионной проводимостью.
Если образующийся сольват диссоциирует на сольватированные ионы:
AB(n+m)S «Ар+nS + Bq-mS,
то в растворе протекает электролитическая диссоциация и система относится к растворам электролитов.
Примеры:
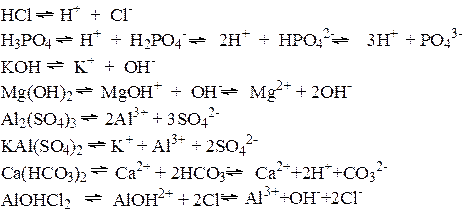
Некоторые электролиты диссоциируют неполностью. Степень диссоциации – количественная характеристика электролитической диссоциации, показывает, какая доля молекул подверглась электролитической диссоциации
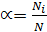 ,
,
где Ni – число молекул растворенного вещества, распавшихся на ионы,
N – общее число молекул растворенного вещества
Сила электролита определяется степенью диссоциации.
Если a < 2 %, то электролит слабый.
Если 2% < a < 30%, то электролит средней силы.
Если a > 30 %, то сильный электролит.
- многие минеральные кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4, HClO3, HMnO4;
- основания щелочных и щелочноземельных металлов;
- почти все растворимые соли (исключения: HgCl2, CdCl2, CdI2, Fe(CNS)3 и некоторые другие);
Слабые электролиты:
- некоторые минеральные кислоты: H2CO3, H2S, H2SO3, HNO2, HClO;
- H2O;
- NH4OH, основания большинства металлов (кроме щелочных и щелочно-земельных).
Ортофосфорная кислота H3PO4 – электролит средней силы.
В растворах слабых электролитов часть молекул распадается на ионы, т.е. диссоциируют, а часть остается в неизменном виде, поэтому устанавливается динамическое равновесие, которое характеризуется константой равновесия
KtAn + (n+m)H2O «Kt+ nH2O + An- mH2O
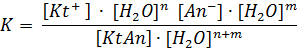
Если в выражении константы равновесия сократить числитель и знаменатель на один и тот же множитель – (H2O)n+m, то мы получим выражение константы диссоциации данного электролита:
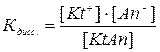
Из данного выражения следует, что Кдисс. будет иметь тем меньшее значение, чем меньше ионов в растворе, т.е. чем слабее электролит.
Константа диссоциации зависит от природы электролита, от природы растворителя, от температуры и не зависит от концентрации, поэтому является более общей характеристикой, чем степень диссоциации. Константа и степень диссоциации связаны между собой законом разбавления Оствальда:
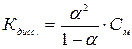
где См – молярная концентрация электролита
Если a<<1, то 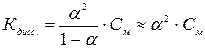
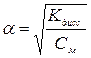
В растворах слабых электролитов взаимодействие ионов друг с другом относительно невелико из – за их незначительной концентрации. Сильные электролиты в растворах диссоциированы практически полностью
NaCl ® Na+ + Cl-
Поэтому концентрация ионов велика, причем возможно взаимодействие ионов как друг с другом, так и с полярнвми молекулами растворителя. В связи с этим возникает эффект уменьшения числа ионов, участвующих в реакции. Для учета сил межионного и ион – дипольного взаимодействия вместо концентрации используют активность вещества
a = f CM,
где f – коэффициент активности, выражает отклонение раствора с концентрацией См от поведения очень разбавленного раствора, в котором отсутствует межионное взаимодействие.
По теории электролитической диссоциации все реакции электролитов в водных растворах являются реакциями между ионами. Такие реакции представляют в виде ионных уравнений. При составлении ионных уравнений реакций каждое вещество записывается в той форме, которая для данного равновесного состояния в растворе является преобладающей.
В виде ионов изображают только сильные растворимые электролиты, все остальные вещества (малодиссоциированные, малорастворимые, газообразные, а также неэлектролиты) записываются в молекулярном виде. Знак ¯ при формуле вещества показывает, что это вещество удаляется из сферы реакции в виде осадка, знак - в виде газа.
Сумма зарядов левой части уравнения должна быть равна сумме зарядов правой части.
Составление уравнений реакций электролитов рекомендуется выполнять в определенной последовательности:
1. Составить молекулярное уравнение.
2. Определить природу исходных и образующихся веществ (сильный и слабый электролит, растворимый или малорастворимый).
3. Переписать уравнение, изобразив каждое вещество в соответствующей форме (в виде ионов – сильные электролиты, в виде молекул - все остальные вещества).
4. Сравнить состав реагирующих и образующихся частиц, выявить одинаковые, следовательно, не принимающие участия в реакции, ионы.
5. Исключить одинаковые ионы, написать сокращенное ионно – молекулярное уравнение.
6. Сделать вывод о возможности необратимого протекания реакции. Необратимо протекают реакции в направлении наибольшего связывания ионов с образованием осадков, газов, слабых электролитов и комплексных ионов.
Если связывания ионов нет, то с точки зрения теории электролитической диссоциации реакция не происходит, но при выпаривании раствора образуется смесь из исходных веществ и продуктов их обмена.
 2015-08-13
2015-08-13 6500
6500








